
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
План дистанционного обучения по химии 11 класс
План дистанционного обучения по химии 11 класс
11.11.2021 г.
Тема урока: Основные виды химической связи
Цель урока: сформировать понятие о химической связи и научить учащихся определять ее тип в различных соединениях по химической формуле вещества.
Дорогие ребята!
На сегодняшнем уроке мы вспомним что такое химическая связь и какие типы химической связи существуют в химических соединениях.
I Этап.Актуализация знаний.
Выполняют самостоятельную работу, где необходимо дать характеристику химического элемента S (сера) по его положению в периодической системе согласно плану:
1)Положение элемента в ПС (номер элемента, период, группа, подгруппа).
2)Схема строения атома. Электронная конфигурация валентного слоя.
3)Валентные возможности элемента
4)Возможные и характерные степени окисления элемента
5)Высший оксид элемента (его формула и характер).
6)Высший гидроксид элемента (его формула и характер).
7)Водородное соединение (его формула).
8)Летучее водородное соединение
II Этап. Изучение нового материала.
Вопрос. Что такое химическая связь?
Химическая связь – это такое взаимодействие атомов, которое связывает их в молекулы, ионы, радикалы, кристаллы.
Химическую связь классифицируют следующим образом:
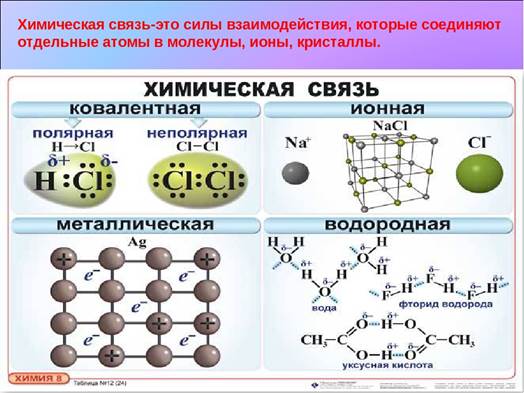
В тетради записать определение понятия «Химическая связь» и изобразить схему «Типы химической связи»
Просмотрите видеоурок по данной ссылке:
https://www.youtube.com/watch?v=3ArLPn7EmNA
Ковалентная химическая связь – это связь, возникающая между атомами за счёт общих электронных пар.
- Что вы знаете о ковалентной химической связи?
Стремление к устойчивой электронной конфигурации за счёт образования общих электронных пар.
1) Обменный механизм
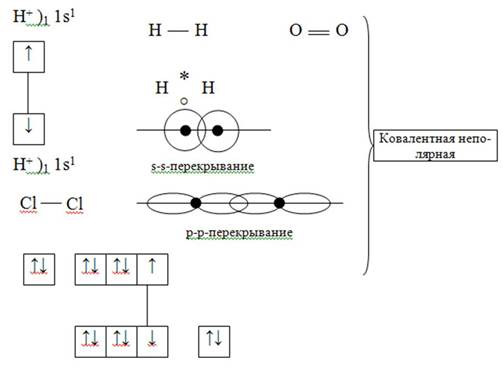

2) Донорно-акцепторный механизм
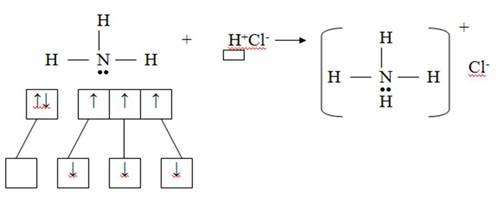
Азот – донор (имеет электронную пару), водород – акцептор (имеет свободную орбиталь)
По числу общих электронных пар (по кратности).
1) Одинарные.
2) Двойные.
3) Тройные.
По степени смещения.
1) Полярные.
2) Неполярные.
- Что такое электроотрицательность?
Электроотрицательность – это способность атомов химических элементов оттягивать на себя общие электронные пары, находящиеся в совместном владении
Неполярная – ковалентная химическая связь, образующаяся между атомами с одинаковой электроотрицательностью.
Полярная – ковалентная химическая связь, образующаяся между атомами с разной электроотрицательностью.
Молекула углекислого газа неполярная, так как имеет линейное строение
Кристаллическая решётка веществ с ковалентной химической связью: атомная и молекулярная. Атомная – очень прочная (графит, алмаз), молекулярная – газы, легколетучие жидкости, твёрдые легкоплавкие вещества (хлор, вода, йод, углекислый газ – «сухой лёд»). Молекулярная кристаллическая решётка непрочная, так как внутримолекулярные связи прочные, межмолекулярное взаимодействие слабое.
- Что вы знаете об ионной связи, ионной кристаллической решётке?
2. Ионная химическая связь – это химическая связь, образовавшаяся за счёт электростатического притяжения катионов к анионам.
Наиболее устойчивая электронная конфигурация атомов 8 электронов - 2s22p6 и 2 электрона - 1s2.
Me0 -nẽ ↔ Men+ (катионы)
неMe0 +nẽ ↔ неMen- (анионы)
Образуется ионная кристаллическая решётка
Физические свойства: твёрдые, прочные, тугоплавкие. 
Растворы и расплавы ионных соединений – электролиты.
- Что такое электролиты?
- Определение электролитической диссоциации?
- Три случая образования электролитов?
Ионная связь – крайний случай ковалентной полярой связи, но в оличие от неё связь ненаправленная.
3. Металлическая связь – связь в металлах и сплавах, которую выполняют относительно свободные электроны между ионами металлов в металлической кристаллической решётке.
Характеристика – ненаправленная, ненасыщенная, небольшое количество валентных электронов, большое количество свободных орбиталей.
Me0 -nẽ ↔ Men+
Физические свойства – твёрдость, тепло- и электропроводность, ковкость, пластичность, металлический блеск.
Металлическая кристаллическая решётка – в узлах ионы или атомы металлов, между которыми свободно перемещаются электроны.
4. Водородная химическая связь – это химическая связь между положительно поляризованными атомами водорода одной молекулы (или её части) и отрицательно поляризованными атомами сильноэлектроотрицательных элементов, имеющих неподелённые электронные пары (F, O, N, реже Cl и S) другой молекулы или другой её части.
Характер связи: частично электростатический, частично донорно-акцепторный.
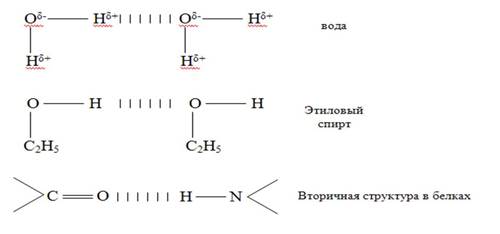
В молекулах ДНК цепи нуклеотидов связаны водородными связями в двойные спирали - принцип комплементарности (Ц-Г, А-Т).
Вещества с водородными связями имеют молекулярные кристаллические решётки.
Единая природа химической связи.
Ионная химическая связь – крайний случай ковалентной полярной химической связи. Металлическая связь совмещает в себе ковалентное взаимодействие атомов и электростатическое притяжение между ионами металлов и их электронами.
LiF – 80% ионной связи и 20% ковалентной полярной.
Основания: между кислородом и водородом в гидроксогруппе о ковалентная полярная связь, между металлом и гидроксогруппой – ионная.
Соли: в кислотном остатке – ковалентная полярная, между металлом и кислотным остатком – ионная.
Домашнее задание:
1. Проработать параграф № 7,8 ст.32-38. Составить краткий конспект материала
2. Выполнить задание № 3 ст.34 письменно
3. Выполнить задание № 3 ст.37 письменно
Задания выполняем в рабочих тетрадях (на период дистанционного обучения их потребуется 2 шт.). В понедельник 15.11. тетрадь с выполненным заданием необходимо принести в школу.
Прислать мне на электронную почту: tanya.gaidamaka@yandex.ua или личным сообщением в соц. cети VK https://vk.com/shpits1991 фото выполненного задания
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|