
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Химия 9 класс. Содержание учебного материала. Изучить текстовый материал
Химия 9 класс
09.11.2021
Выполненные в рабочей тетради задания присылать на эл.адрес:vikusja1_87@mail.ru либо в https://vk.com/id22224588
Тел.: 071 350 95 40 (Viber и WhatsApp)
НЕ ЗАБЫВАЕМ УКАЗЫВАТЬ ФАМИЛИЮ В ТЕКСТЕ ПИСЬМА!
Тема: «Диссоциация кислот, оснований и солей в водных растворах. Катионы и анионы»
Цель:дать представление о механизме диссоциации.
Содержание учебного материала
Посмотреть видеоролик по ссылке:https://youtu.be/Z6FTF8oqYRI
Изучить текстовый материал
Кислоты — это электролиты, в результате диссоциации которых в растворах образуется только один вид катионов — ионы Водорода H+.
Если в состав кислоты входит несколько атомов Водорода, диссоциация протекает ступенчато:
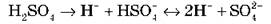
Вместе записываем на доске уравнение диссоциации веществ:
HI, H2SО3, H3PО4 .
Для сильных кислот значок « 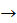 » в уравнении диссоциации указывает на то, что в растворе они полностью диссоциируют на ионы.
» в уравнении диссоциации указывает на то, что в растворе они полностью диссоциируют на ионы.
Для средних и слабых кислот значок « 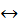 » указывает на обратимость процесса, в растворе одновременно находятся ионы и молекулы, которые не продиссоциировали.
» указывает на обратимость процесса, в растворе одновременно находятся ионы и молекулы, которые не продиссоциировали.
Понятие о ионе гидроксония (рассказ учителя)
Основания — это электролиты, в результате диссоциации которых в растворе образуется только один вид анионов — ионы ОH-.
NaOH 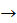 Na+ + ОH-
Na+ + ОH-
Если в состав основания входят две и более гидроксильной группы, диссоциация протекает ступенчато:
Ca(OH)2 ↔ CaOH+ + OH- ↔ Ca2+ + 2OH-
Вместе записываем на доске уравнение диссоциации веществ:
RbОH, Ba(ОH)2.
Для записи уравнений диссоциации щелочей используют значок « 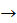 », для записи уравнений диссоциации других оснований — значок «
», для записи уравнений диссоциации других оснований — значок « 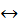 ». Нерастворимые основания на ионы не диссоциируют
». Нерастворимые основания на ионы не диссоциируют
Соли — это электролиты, в результате диссоциации которых в растворе образуются катионы металлов и анионы кислотных остатков.
Соли (растворимые) относятся к сильным электролитам, диссоциируют на ионы полностью в течение одной стадии.
NaNO3 → Na+ + NO3 – ; Na2SO4 → 2 Na+ + SO42-
Al2(SO4)3 → 2Al3+ +3 SO42-
Задания для выполнения письменно в тетради:
1. Записываем в рабочую тетрадь эту таблицу:

2. Из учебника по данной ссылке: https://rabochaya-tetrad-uchebnik.com/himiya/uchebnik_himiya_9_klass_rudzitis_feljdman/index.html#prettyPhoto прочитать параграф 2 (жмем на цифру 7, откроется страница 9).
3. После прочтения параграфа жмем на цифру 9, откроется страница 13, выполняем оттуда письменно в тетради номер 7.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|