
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Д/з на 10 ноября 9 Химия. ноября. Практическая работа №1. Тема: Реакции ионного обмена. РАБОТА ОБЯЗАТЕЛЬНАЯ! ПИСАТЬ В ТЕТРАДИ И НЕ ТЕРЯТЬ!. ФОТО РАБОТЫ КАК ОБЫЧНО В ВК. Условия протекания реакций ионного обмена. Если образуется нерастворимое или малораств
Д/з на 10 ноября 9 Химия
в тетради пишем:
10 ноября
Практическая работа №1
Тема: Реакции ионного обмена
Цель:закрепить теоритические знания по условиям протекания реакций
ионного обмена и навыки составления уравнений в молекулярной и ионной форме.
После цели: внимательно читаем все до задания!!!
Задания решаем в тетради - сначала в молекулярном виде, затем в ионном.
Напоминаю - слева у вас две соли растворимые в воде (смотрите в таблицу растворимости), а справа одно вещество или нерастворимаое, малорастворимое или газ.
РАБОТА ОБЯЗАТЕЛЬНАЯ! ПИСАТЬ В ТЕТРАДИ И НЕ ТЕРЯТЬ!
ФОТО РАБОТЫ КАК ОБЫЧНО В ВК
Реакции ионного обмена- реакции, протекающие в водных растворах электролитов между ионами, образующимися в результате диссоциации.
Условия протекания реакций ионного обмена
Реакции ионного обмена идут до конца в трех случаях:
1.Если образуется нерастворимое или малорастворимое вещество, выпадающее в осадок ( ↓ )
CuSO4 + 2NaOH = Cu(OH)2↓+ Na2SO4
Cu2+ + SO42- + 2Na+ + 2OH- = Cu(OH)2 ↓+ 2Na+ + SO42-
Cu2+ + 2OH- =Cu(OH)2↓
2. Еслиобразуетсяосадок( )
Na2CO3 + 2HCl = H2CO3 (H2O + CO2)+ 2NaCl
2Na+ + CO32- + 2H+ + 2Cl- =H2O + CO2 + 2Na+ + 2Cl-
CO32- + 2H+=H2O + CO2 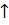
3. Если образуется слабый электролит
HCl + NaOH=NaCl + H2O
H+ + Cl- + Na+ + OH-= Na+ + Cl- + H2O
H+ + OH- = H2O
Реакции ионного обмена не протекают до конца,т.е. являются обратимыми,если образуются два сильных электролита:
KNO3 + NaCl= NaNO3 + KCl
K+ + NO3- + Na+ + Cl-= Na+ + NO3- + K+ + Cl-
Запомни!
ü Формулы сильных электролитов записываются в ионном виде.
ü Формулы слабых и средних электролитов записываются в молекулярном виде.
ü Формулы нерастворимых и малорастворимых веществ записываются в молекулярном виде.
ü Формулы газов и других неэлектролитов записываются в молекулярном виде.

| АЛГОРИТМ составления ионных уравнений |
| 1. | Составить схему химического взаимодействия: слева записать исходные вещества, справа продукты реакции. Подобрать коэффициенты. | Na2 SO4+ Ba Cl2=Ba SO4↓+2Na Cl |
| 2. | По таблице растворимости определить растворимые и нерастворимые вещества,
если вещество выпадает в осадок,
стрелку вниз ( 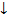 ),если выделяется газ,стрелку вверх ( ),если выделяется газ,стрелку вверх ( 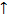 ) )
| Na2 SO4+ Ba Cl2=Ba SO4↓+2Na Cl Р РHР |
| 3. | Записать уравнение в ионной-молекулярном виде:растворимые электролиты в ионной форме, нерастворимые в молекулярной форме. | 2Na++SO2-4+ Ba2++2Cl-= Ba SO4↓+2 Na++2 Cl- |
| 4. | Одинаковые ионы, не изменившие своего состояния, исключаем из левой и правой части уравнения и записываем краткое ионное уравнение. | SO2-4+ Ba2+= Ba SO4↓ |
Пример:
Взаимодействие сульфата натрия с хлоридом бария:
1.В молекулярном виде:
Na2SO4+ BaCl2=BaSO4↓+2NaCl
Р Р Н Р
2.В ионно-молекулярном виде:
2Na++SO2-4+ Ba2++2Cl-= Ba SO4↓+2 Na++2 Cl-
3.В сокращенном ионном-молекулярном виде:
SO2-4+ Ba2+= BaSO4↓
ЗАДАНИЕ:Составить уравнения реакции ионного обмена между
заданными веществами молекулярной и ионной форме:
1. сульфат калия и гидроксид бария
2. гидроксид калия и хлорид магния
3. карбонат калия и азотная кислота
4. гидроксид натрия и сернистая кислота.
5. сульфат натрия и нитрат бария
6. хлорид железа и гидроксид бария
Срок выполнения до 12 ноября
Фотографии работ сюда https://vk.com/id684306352
личными сообщениями
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|