
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Тема: Ступенчатая диссоциация кислот. Ион гидроксония. Катионы и анионы.
ЗАДАНИЯ ДЛЯ ДИСТАНЦИОННОГО ОБУЧЕНИЯ
ПО ПРЕДМЕТУ « ХИМИЯ » , 9 класс
16.11.2021.
Тема: Ступенчатая диссоциация кислот. Ион гидроксония. Катионы и анионы.
Для успешного освоения материала использовать видео-уроки по ссылке:
https://yandex.fr/video/preview/?filmId=16580446407958181101&text=ступенчатая+диссоциация+кислот.&where=all
https://yandex.fr/video/preview/9926099707584575529
Прочитать дополнительный материал( смотри ниже), §7, ответить на вопросы стр.29 №1,2 ( письменно). Подготовиться к контрольной работе.
Катионами называют положительно заряженные ионы.
Анионами называют отрицательно заряженные ионы.
В процессе развития химии понятия «кислота» и «основание» претерпели серьёзные изменения. С точки зрения теории электролитической диссоциации кислотами называют электролиты, при диссоциации которых образуются ионы водорода H+, а основаниями — электролиты, при диссоциации которых образуются гидроксид-ионы OH–. Эти определения в химической литературе известны как определения кислот и оснований по Аррениусу.
Такие свойства кислот, как взаимодействие с металлами, основаниями, основными и амфотерными оксидами, способность изменять окраску индикаторов, кислый вкус и т. д., обусловлены наличием в растворах кислот ионов H+. Число катионов водорода, которые образуются при диссоциации кислоты, называют её основностью. Так, например, HCl является одноосновной кислотой, H2SO4 — двухосновной, а H3PO4 — трёхосновной.
Многоосновные кислоты диссоциируют ступенчато, например:
При диссоциации кислот роль катионов играют ионы водорода (H+), других катионов при диссоциации кислот не образуется:
HF ↔ H+ + F-HNO3 ↔ H+ + NO3-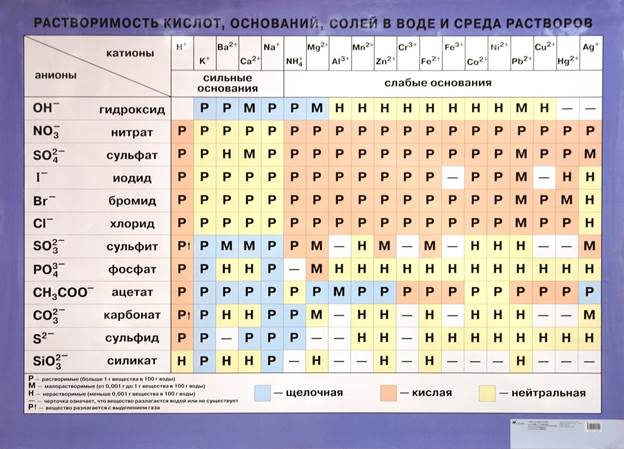
Именно ионы водорода придают кислотам их характерные свойства: кислый вкус, окрашивание индикатора в красный цвет и проч.
Отрицательные ионы (анионы), отщепляемые от молекулы кислоты, составляеют кислотный остаток.
Одной из характеристик диссоциации кислот является их оснОвность - число ионов водорода, содержащихся в молекуле кислоты, которые могут образоываваться при диссоциации:
· одноосновные кислоты: HCl, HF, HNO3;
· двухосновные кислоты: H2SO4, H2CO3;
· трехосновные кислоты: H3PO4.
Процесс отщепления катионов водорода в многоосновных кислотах происходит ступенчато: сначала отщепляется один ион водорода, затем другой (третий).
Ступенчатая диссоциация двухосновной кислоты:
H2SO4 ↔ H+ + HSO4-HSO4- ↔ H+ + HSO42-Ступенчатая диссоциация трехосновной кислоты:
H3PO4 ↔ H+ + H2PO4-H2PO4- ↔ H+ + HPO42-HPO42- ↔ H+ + PO43-При диссоциации многоосновных кислот самая высокая степень диссоциации приходится на первую ступень. Например, при диссоциации фосфорной кислоты степень диссоциации первой ступени равняется 27%; второй - 0,15%; третьей - 0,005%.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|