
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
тоқсанның жиынтық бағалауына шолу
2-ТОҚСАННЫҢ ЖИЫНТЫҚ БАҒАЛАУ СПЕЦИФИКАЦИЯСЫ
2-тоқсанның жиынтық бағалауына шолу
Жиынтық бағалаудың өткізілу уақыты –40 минут
Балл саны –25
Тапсырма түрлері:
КДЖ– Көп дұрыс жауапты таңдауды қажет ететін тапсырмалар;
ҚЖ– Қысқа жауапты қажет ететін тапсырмалар;
ТЖ –Толық жауапты қажет ететін тапсырмалар.
Жиынтық бағалаудың құрылымы
Тоқсан бойынша жиынтық бағалауда әртүрлі тапсырмалар: көп жауапты таңдауы бар сұрақтар, қысқа/толық жауапты қажет ететін сұрақтар қолданылады.
Қысқа жауапты қажет ететін сұрақтарға сөздер немесе қысқа сөйлемдер түрінде жауап береді.
Толық жауапты қажет ететін сұрақтарда білім алушылар орындаушылық және шығармашылық дағдыларын көрсетеді.
Нұсқа: 11 тапсырмадан тұрады: соның ішінде бірнеше жауап нұсқаларынан тұратын сұрақтар, қысқаша жауапты қажет ететін сұрақтар, толық жауапты қажет ететін тапсырмалар берілген.
Тоқсандық жиынтық бағалау тапсырмаларының сипаттамасы 2-тоқсан
| Бөлім | Тексерілетін мақсат | Ойлау дағдыларын ың деңгейі | Тапсыр ма саны* | № тапсыр ма* | Тапсыр ма түрі* | Орындау уақыты, мин* | Балл* | Бөлі м бойы нша балл | |
| 9.1А Электролиттік диссоциация | 9.4.1.4 -иондық және коваленттік полюсті байланысы бар заттардың электролиттік диссоциациялану механизмін түсіндіру | Қолдану | ҚЖ ТЖ | ||||||
| 9.4.1.6 -қышқыл, сілті, орта және қышқылдық тұздардың электролиттік диссоциациялану теңдеулерін құрастыру | Қолдану | ТЖ | |||||||
| 9.4.1.7 -күшті және әлсіз электролиттерге мысал келтіру және оларды ажырату, диссоциациялану дәрежесін анықтай білу | Қолдану | ТЖ | |||||||
| 9.3.4.1 -қышқылдар, еритін және ерімейтін негіздер, орта тұздардың химиялық қасиеттерін көрсететін реакция теңдеулерін молекулалық және иондық түрде құрастыру | Қолдану | 1
| 4
| ТЖ | |||||
|
ТЖ | |||||||||
| 9.3.4.5 -орта тұз ерітіндіcінің реакция ортасын болжау | Жоғары деңгей дағдылары | 11 1 |
| 9.1В Бейорганика- лық қосылыстар- дың сапалық талдауы | 9.4.1.9 -Fe2+, Fe3+, Cu2+ катиондарын анықтау үшін сапалық реакция жүргізу | Қолдану | ТЖ | |||||
| 9.4.1.10 -хлорид-, бромид-, йодид-, сульфат, карбонат-, фосфат-, нитрат-, силикат- иондарына сапалық реакцияларды тәжірибе жүзінде жүргізу және ион алмасу реакцияларын бақылап нәтижесін сипаттау | Қолдану | ТЖ | ||||||
| 9.2.3.1 -әрекеттесуші заттардың біреуі артық берілген реакция теңдеулері бойынша есептеулер жүргізу | Қолдану | ТЖ | ||||||
| 9.1С Химиялық реакция жылдамдығы | 9.3.2.2 -реакция жылдамдығына әсер ететін факторларды анықтау және оны бөлшектердің кинетикалық теориясы тұрғысынан түсіндіру | Жоғары деңгей дағдылары | ТЖ | |||||
| 9.3.2.3 -катализатордың реагенттен айырмашылығын және реакция жылдамдығына әсерін түсіндіру | Қолдану |
| ТЖ | |||||
| 9.3.2.4 -реакция жылдамдығына ингибитордың әсерін түсіндіру | Білу және түсіну | 1 | ҚЖ | |||||
| 9.1D Қайтымды реакциялар | 9.3.3.2 - тепе-теңдікті динамикалық үдеріс ретінде сипаттау және Ле- Шателье-Браун принципі бойынша химиялық тепе-теңдіктің ығысуын болжау | Жоғары деңгей дағдылары | ҚЖ /ТЖ | |||||
| Барлығы |
ТЖБ 9сынып Барлығы 25 балл]
1. Иондық және ковалентті полюсті байланысы бар заттар қатарын көрсет
а) A) Al, N2 B) AlCl3, HCl C) H2, H2O D)KCl, CuO
b) AlCl3 - нің электролиттік диссоциациялану теңдеуін жазыңыз
________________________________________________________________
[2]
2. Ba(OH)2, NaHSO4 заттардың электролиттік диссоциациялану теңдеулерін құрастырыңыз
_________________________________________________________________
_________________________________________________________________ [2]
3.Егер ерітіндідегі 200 молекуланың 20-сы ыдыраса, электролиттік диссоциациялану дәрежесі неге тең болады?
_________________________________________________________________
_________________________________________________________________[1]
4.Генетикалық қатардағы өзгерістерді жүзеге асыруға болатын реакция теңдеулерін жазып, тұнбаға түскен заттың молекулалық толық және иондық теңдеулерін жазыңдар.
Ba 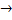 ?
? 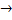 Ba(OH)2
Ba(OH)2 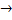 ?
? 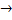 BaSO4
BaSO4
_________________________________________________________________
_________________________________________________________________
_________________________________________________________________ [1]
5. Мыс (II) нитраты ерітіндісі гидролизінің молекулалық және иондық теңдеулерін жазыңдар және лакмус түсіне қарай ортасын көрсетіңіздер.
Лакмустың түсі неліктен өзгереді?
_________________________________________________________________ [2]
6.Темір (ІІ, ІІІ) хлоридтеріне натрий гидроксидінің ерітіндісін құйып , түзілген тұнбалардың түсін көрсет және реакция теңдеулерін жазыңдар.
________________________________________________________________
[1]
7. NaCl, NaBr, NaI бар тұз ерітінділеріне күміс нитраты ерітіндісін әрекеттестіріңдер.
Реакциялардың иондық теңдеулерін жазыңдар.
_________________________________________________________________
_________________________________________________________________
_________________________________________________________________
[1]
8. Құрамында 12,6 г барий нитраты бар ерітіндіге 14,5 г калий сульфаты бар ерітінді қосылды.Қанша грамм барий сульфаты тұнбаға түскенін есептеңдер.
[2]
9.a) P+3H2=2 P H3 реакциясына қатысатын P заттың бастапқы концентрациясы 0,32 моль/л, ал 10 секунд өткеннен кейінгі концентрациясы 0,22 моль/л. Реакциясының орташа жылдамдығын табыңыздар. Бұл уақыт ішінде H2 және PH3 газының концентрациясы қалай өзгерді? Фосфордың концентрациясы кинетикалық жылдамдығына әсер ете ма?
[4]
b) Химиялық реакциялардың жылдамдығына қандай факторлар әсер етеді?
Неліктен тамақ өнімдерін төмен температурада тоңазытқышта сақтайды?
____________________________________________________________
_______________________________________________________________________
[2]
10. а Зертханада оттекті a) бертолле тұзынан KClO3, b) сутек пероксидінен H2O2, (марганец диоксиді MnO2 (катализатор) қатысында алады. Аталған реакциялар катализдің қай түріне жатады.
Тиісті реакция теңдеулерін жазыңдар
_________________________________________________________________
_________________________________________________________________
[2]
б) Тежегіштер (ингибиторлар) дегеніміз не?
_________________________________________________________________
[1]
11.
а)Тепе-теңдікте тұрған жүйеге түрлі факторлардың (c,t,p) әсерін қандай принцип анықтайды.
-------------------------------------------------------------------------------------------------
b) Осы принципке сүйене отырып, мына реакциядағы тепе-теңдік H2 газының түзілу жағына ығысу үшін факторлар (қысым, температура, концентрация) қалай әсер етеді.
CH4  C+2H2 -Q
C+2H2 -Q
_________________________________________________________________
_________________________________________________________________ [4]
| № | Жауап | Балл | Қосымша ақпарат |
| а) В 1 балл b) AlCl3--Al3++ 3Cl- электролиттік диссоциациялану теңдеуі 1 балл HCl --H++ Cl- | |||
| Ва (ОН) 2 = Ва2+ + 2ОН- электролиттік диссоциациялану теңдеуі 2 балл NaHSO4 = Na+ + HSO42- HSO4- = H+ + SO42- | |||
 200----------20
200----------20 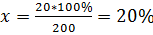 100% -------X есептің шартын орындағаны үшін 1 балл
100% -------X есептің шартын орындағаны үшін 1 балл
| |||
2Ba+O2=2BaO
BaO+H2O=Ba(OH)2
Ba(OH)2+ HCl =BaCl2+ H2O Өзгерістерді жүзеге асырғаны үшін 1-балл
BaCl2+H2SO4=BaSO4  +2 HCl
Ba2+ + 2Cl- +2H+ + SO42- = BaSO4 +2 HCl
Ba2+ + 2Cl- +2H+ + SO42- = BaSO4  +2H+ + 2Cl-
Ba2+ + SO42--= BaSO4 +2H+ + 2Cl-
Ba2+ + SO42--= BaSO4 
| |||
І-ші саты
Cu(NO3)2 + HOH = CuOHNO3 + HNO3
Cu2+ 2NO3- + HOH = CuOH+ + NO3- + H+ + NO3-
Cu2+ + HOH = CuOH+ + H+
ІІ-ші саты
CuOHNO3 + HOH = Cu(OH)2  + HNO3
CuOH+ + NO3- + HOH = Cu(OH)2 + HNO3
CuOH+ + NO3- + HOH = Cu(OH)2  + H+ + NO3-
CuOH+ + HOH = Cu(OH)2 + H+ + NO3-
CuOH+ + HOH = Cu(OH)2  + H+
Толық иондық теңдеулері 1 балл
Орта қышқылдық болғандықтан лакмустың түсі мыс нитратында қызарады 1 -балл + H+
Толық иондық теңдеулері 1 балл
Орта қышқылдық болғандықтан лакмустың түсі мыс нитратында қызарады 1 -балл
| |||
| FeCl₂ + 2NaOH = Fe(OH)₂ ↓ + 2NaCl Fe²⁺ + 2Cl⁻ + 2Na⁺ + 2OH⁻ = Fe(OH)₂ + 2Na⁺ + 2Cl⁻ Fe²⁺ + 2OH⁻ = Fe(OH)₂ ↓ Толық иондық теңдеулері 1 балл FeCl3 + 3NaOH → Fe(OH)3↓ + 3NaCl Fe3+ + 3Cl− + 3Na+ + 3OH− = Fe(OH)3 + 3Na+ + 3Cl− Fe3+ + 3OH− = Fe(OH)3↓ | |||
| 1. NaCl + AgNO3 = NaNO3 + AgCl↓ Na+ + Cl- + Ag+ + NO3- = Na+ +NO3- + AgCl↓ Cl- + Ag+ = AgCl↓ 2. NaBr+AgNО3= NaNО3 + AgBr↓ Иондық теңдеулері 1 балл Na++Br- + Ag + + NО3- = NaNО3- + AgBr↓ Br- + Ag += AgBr↓ 3. NaI+AgNO3 = AgI↓+NaNO3 Na+ + I- + Ag+ +NO3- = AgI↓+Na+ + NO3- I- + Ag+ = AgI↓ | |||
Берілгені Шешуі
m(Ba(NO3)2)= 12,6г 12,6 14,5 Х
m(K2SO4)= 14,5г Ba(NO3)2+ K2SO4--BaSO4 ↓ + 2KCl
261 174 233
Т/к-? Мr(Ba(NO3)2)=137+(14+16*3 )*2=261 г/моль
m(Ba SO4)-? ν 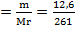 = 0,05 моль
Мr(K 2SO 4)=39*2+32+16*4=137 г/моль
ν = 0,05 моль
Мr(K 2SO 4)=39*2+32+16*4=137 г/моль
ν 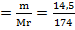 = 0,08 моль
0,05 = 0,08 моль
0,05 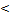 0,08
Х=12,6*233/261=11,3 г
Ж:11,3 г BaSO4 тұнба түзілді
Реакция теңдеуін құру және Зат мөлшерін табу 1 балл
Тұнбаның массасын есептеу 1 балл 0,08
Х=12,6*233/261=11,3 г
Ж:11,3 г BaSO4 тұнба түзілді
Реакция теңдеуін құру және Зат мөлшерін табу 1 балл
Тұнбаның массасын есептеу 1 балл
| |||
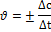
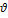 = = 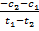 = = 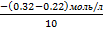 = = 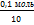 = 0,1 моль/л с
1-балл
Сутек концентрациясы кемиді 1 -балл
Фосфин концентрациясы артады 1 балл
Фосфор қатты күйде болғандықтан кинетикалық теңдеудегі әрекеттесуші заттардың концентрациясы кірмейді. Өйткені олардың концентрациясы тұрақты 1-балл
b) жанасу ауданы, температура, әрекеттесуші заттардың табиғаты , концентрация, қысым, катализатор 1- балл
Температура артқан сайын тағамның құрамындағы химиялық реакциялар жүзеге асып соның салдарынан тамақ бүліне бастайды 1-балл = 0,1 моль/л с
1-балл
Сутек концентрациясы кемиді 1 -балл
Фосфин концентрациясы артады 1 балл
Фосфор қатты күйде болғандықтан кинетикалық теңдеудегі әрекеттесуші заттардың концентрациясы кірмейді. Өйткені олардың концентрациясы тұрақты 1-балл
b) жанасу ауданы, температура, әрекеттесуші заттардың табиғаты , концентрация, қысым, катализатор 1- балл
Температура артқан сайын тағамның құрамындағы химиялық реакциялар жүзеге асып соның салдарынан тамақ бүліне бастайды 1-балл
| Осыған ұқсас балама жауаптар қабылданады | ||
| Жүйе бір фазада болғандықтан гомогенді катализ деп аталады 1 балл b) 2KClO3 MnO2 2KCl+3O2 2H2O2 MnO2 2H2O + O2 Реакция теңдеулерін құрғаны үшін 1 балл с) Химиялық реакциялардың жылдамдығын баяулататын заттар тежегіштер (ингибиторлар) деп аталады 1- балл | |||
| a) Ле-Шателье-Браун 1- балл b) 1. Температураны жоғарылату қажет 1- балл 2. Қысымды төмендету қажет 1- балл 3. Метанның концентрациясын арттыру қажет 1- балл | |||
| Барлығы | |||
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|