
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Тема «Строение электронных оболочек атомов элементов малых периодов»
Преподаватель: Кононенко Екатерина Анатольевна
Урок № 14
Дата 28.10.2021
Задания выполнить на двойном листе, выполненные задания сфотографировать и прислать в социальной сети «Вконтакте» личным сообщением до 30.10.21
Тема «Строение электронных оболочек атомов элементов малых периодов»
Задания:
1. Просмотреть видеоматериал по ссылке. https://www.youtube.com/watch?v=Ohc2btNpKsM&feature=emb_title
2. Прочитать теоретический материал.
3. Составить краткий конспект.
4. Составить электронные графические формулы химических элементов третьего периода.
5. Написать электронные конфигурации элементов второго и третьего периода.
Теоретический материал
Электроны различаются своей энергией, чем дальше от ядра расположены электроны тем большим запасом энергии они обладают. Всегда в атоме имеются электроны С близкими значениями энергии, которые и образуют электронные слои в оболочке атома.
Число электронных слоёв равно номеру периода в периодической системе. Максимальное число электронов на слое можно найти с помощью формулыN=2n2,где N-число электронов на слое, n-номер слоя. Произведя простые рассчёты, выясним что на первом электронном слое будет 2 электрона, на втором-8, третьем-18, четвёртом-32. Но на внешнем электронном слое не может быть более 8 электронов, а для первого слоя не более 2. Это небходимо учитывать при распределении электронов по энергетическим слоям.
Рассмотрим несколько примеров заполнения электронных оболочек.
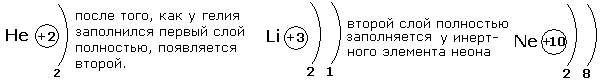
После заполнения второго слоя до восьми электронов появляется третий слой.


Третий электронный слой заполняется до максимального числа -18 электронов. После этого начинает заполняться внешний четвёртый слой до 8 электронов.
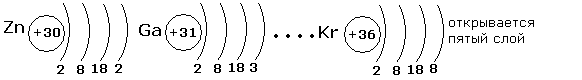
Внешний электронный слой заполняется у элементов главных подгрупп, причём число электронов соответствует номеру группы. У элементов побочных подгрупп заполняются предвнешние слои, а на внешнем слое остаётся чаще всего два электрона. У d-элементов заполняется предвнешний слой, а у f-элементов третий снаружи слой.
Распределение электронов по уровням можно записать с помощью ячеек Хунда:
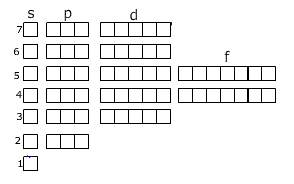
Здесь уровни разделены на подуровни. В периодической системе элементы подразделяются на s-, p-, d-, f-элементы. Какой подуровень заполняется последним, к такой группе и относится данный элемент. Например, последний электрон занимает одну из р-орбиталей, то этот элемент относится к р-элементам.
При заполнении ячеек электроны обозначаются стрелками (одна стрелка направлена вверх, другая вниз, это связано с тем, что электроны вращаются вокруг своей оси-один по часовой, другой-против часовой стрелки), причём в одной ячейке могут находиться не более двух электронов.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|