
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Группа3А. Предмет Физика
19.10.2021
Преподаватель:Земляная С.Н.
Группа3А
Предмет Физика
Урок №8
Тема программы:Физика атома
Тема урока:Квантовые постулаты Бора. Модель атома водорода по Н. Бору.
https://www.youtube.com/watch?v=2xUsH8miHc0&ab_channel=LiameloNSchool
На прошлом уроке мы с вами рассматривали опыты Эрнеста Резерфорда по рассеянию альфа-частиц, которые позволили учёному создать ядерную (или планетарную) модель атома.

Однако при всей своей убедительности планетарная модель атома оказалась внутренне противоречивой. По законам электродинамики движущийся ускоренно заряд излучает электромагнитные волны. Следовательно, атом должен непрерывно излучать электромагнитные волны. Излучение же связано с уменьшением энергии электрона в поле ядра. Следствием этого должно явиться уменьшение скорости движения и частоты вращения электронов вокруг ядра. Если частота непрерывно изменяется, то спектр излучения атома должен быть сплошным. Уменьшение скорости электрона должно привести к тому, что электрон будет двигаться по спирали к ядру и в течение короткого времени упадёт на него, то есть в этой модели атом должен быть неустойчивым.
Это находится в полном противоречии с экспериментальными фактами, которые свидетельствуют о том, что:
· атом является достаточно устойчивой системой;
· атом излучает электромагнитные волны лишь при определенных условиях, а не непрерывно;
· а спектры излучения атомов являются линейчатыми.
В современном виде постулаты Бора формулируются следующим образом.
Первый постулат Бора (постулат стационарных состояний):
атом может находиться в особых стационарных (квантовых) состояниях, каждому из которых соответствует определенная энергия. Находясь в стационарном состоянии, атом не излучает и не поглощает энергию.
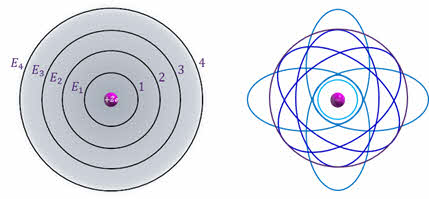
Стационарные состояния можно пронумеровать, присвоив им порядковые номера, причём каждому состоянию соответствует определенное дискретное значение энергии. Согласно модели Бора стационарным состояниям атома соответствуют определенные (разрешённые) орбиты, по которым электроны движутся вокруг ядра. При движении по этим орбитам электроны не излучают электромагнитные волны.
Первый постулат противоречит нашим представлениям о движении в классической механике, так как мы знаем, что скорость тел изменяется постепенно и может принимать любые значения. Бор вводит понятие квантования скоростей и орбит электрона: скорости и радиусы орбит могут изменяться не непрерывно, а имеют только определённый дискретный набор значений.
Второй постулат Бора ещё называют правилом частот:
атом может переходить из одного стационарного состояния в другое. При этом переходе может испускаться или поглощаться квант электромагнитного излучения, частота которого определяется разностью энергий атома в данных состояниях:
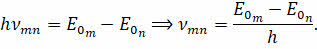
Из формулы следует, что если электрон переходит с более низкой орбиты на более высокую, то он поглощает квант энергии. Если же наоборот, переход осуществляется с более высокой на более низкую орбиту, то электрон излучает квант энергии.
Состояние атома, которому соответствует наименьшая энергия, называется основным. А состояния, которым соответствуют большие значения энергии, — возбуждёнными. В основном энергетическом состоянии атом может находиться неограниченно долго, а в остальных стационарных состояниях порядка 10–6 с. Это так называемое время жизни атома в возбуждённом состоянии.
Как следует из второго постулата Бора, частота излучения атома не связана с частотой вращения электрона по орбите, она определяется разностью значений энергии атома в начальном и конечном состояниях. Переход атома из одного стационарного состояния в другое сопровождается электромагнитным излучением определённой длины волны:
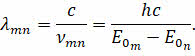
Для объяснения же эмпирических закономерностей в спектре атома водорода эти два постулата были дополнены правилом квантования орбит, которое иногда называют третьим постулатом Бора:
в стационарном состоянии атома электрон, движущийся по круговой орбите, должен иметь квантованные (дискретные) значения момента импульса, которые удовлетворяют условию:
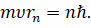
В записанной формуле m — это масса электрона, υ — его скорость на n-й орбите, rn — радиус стационарной орбиты, а n = 1, 2, 3, ... — это номер орбиты электрона.
Таким образом, постулаты Бора основывались на трёх экспериментальных предпосылках — результатах исследования атомных спектров, квантовой теории излучения, развитой Планком и Эйнштейном, и ядерной (планетарной) модели атома Резерфорда.
Исходя из этих постулатов и используя планетарную модель строения атома, Нильс Бор разработал количественную теорию атома водорода. Он рассчитал радиусы стационарных орбит электрона в атоме водорода и вычислил соответствующие им значения энергии.
В 1922 году Нильсу Бору была присуждена Нобелевская премия «за заслуги в исследовании строения атомов и излучения», так как его исследования фактически положили начало новому этапу развития спектроскопии, которая из эмпирической науки превратилась в эффективный метод изучения атомной структуры. Спустя пол века по этому поводу Бор скажет: «Я увидел путь рождения спектров!»
Итак, что же дала нам модель атома водорода по Бору. Во-первых, она позволила вычислить энергию ионизации атома водорода, хорошо согласующуюся с экспериментом. А во-вторых, дала мощный толчок к объяснению закономерностей периодической системы химических элементов Менделеева. Согласно модели атома Бора электроны движутся по определенным орбитам, образующим различные группы — электронные оболочки. Структура электронных оболочек определяет химические свойства элементов, которые периодически повторяются по мере заполнения оболочек электронами. Это позволило «предсказывать» свойства ранее неизвестных элементов.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|