
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Тема «Способы получения металлов»
Преподаватель: Кононенко Екатерина Анатольевна
Урок № 24
Дата 19.11.21
Задания выполнить на двойном листе, выполненные задания сфотографировать и прислать в социальной сети «Вконтакте» личным сообщением до 22.11.2021
Тема «Способы получения металлов»
Задания:
1. Прочитать теоретический материал.
2.Просмотреть видео по ссылке https://www.youtube.com/watch?v=sLL3Oqu9gXc&feature=emb_title
3. Составить краткий конспект.
4. Ответить на вопросы, выполнить задание:
1. Почему атомы металлических элементов сравнительно легко отдают валентные электроны?
2. Какие металлы условно принято называть легкими, а какие - тяжелыми?
3. Какой металл самый легкий, какой - самый тяжелый? Укажите их плотность
4. Какой металл самый тугоплавкий?
5. Какие металлы называют легкоплавкими, а какие - тугоплавкими?
6. Какие металлы самые мягкие?
7. Из оксида железа FeO4 можно получить железо алюминотермическим способом. Составьте уравнение этой реакции и покажите переход электронов.
Теоретический материал
С развитием производства металлов и сплавов связано возникновение цивилизаций. История цивилизаций Древнего Египта, Древней Греции, Вавилона и других государств неразрывно связана с развитием производства металлов и сплавов: Медный век, Бронзовый век, Железный век. Самые известные памятники Древнего мира египетские пирамиды (огромные каменные гробницы фараонов). Каменные пирамиды являются творениями медного века, так как для сооружения пирамид использовались медные орудия труда.
Слово «металл» произошло от греческого слова métallon – выкапываю, добываю из земли, которое означало первоначально копи, рудники (в этом смысле оно встречается у Геродота, 5 век до н. э.). То, что добывалось в рудниках, Платон называл metallon.
Содержание некоторых металлов в земной коре:
алюминий - 8,2%,
железо- 5,0%,
кальций - 4,1%,
натрий- 2,3%,
магний- 2,3%,
калий- 2,1%.
В природе могут встречаться только в свободном (самородном) виде благородные металлы - Au золото, Pt платина; в самородном виде и в виде соединений (Ag серебро, Cu медь, Hg ртуть, Sn олово и малоактивные металлы ); только в виде соединений (металлы, стоящие в ряду напряжений до Sn олова).
В XIX веке русским учёным Н. Н. Бекетовым был научно обоснован и предложен пирометаллургический метод получения металлов. Пирометаллургия это восстановление металлов из руд при высоких температурах с помощьювосстановителей: углерода, оксида углерода (II), водорода, алюминия. В XIX веке Н.Н. Бекетов впервые осуществил металлотермические опыты получения металлов. Открыл процесс вытеснения металлов из растворов солей под действием других металлов. Установил закономерность «…каждый предыдущий металл активнее последующего и вытесняет менее активные металлы из растворов солей или расплавов оксидов. На основании многолетней опытной работы в 1863 году Бекетов составил «вытеснительный ряд», который является прототипом электрохимического ряда напряжений металлов.
Существуют различные способы обогащения руды. Один из них – флотация.
Для получения металлов из руд необходимо перевести металлы из руд в какую-нибудь единую форму, чаще всего в форму оксидов.
2CuS +3 O2 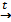 2CuO + 2SO2
2CuO + 2SO2
4FeS2 +11O2 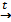 2Fe2O3 + 8SO2
2Fe2O3 + 8SO2
Полученные оксиды можно восстанавливать несколькими способами.
1. Один из основных – это металлотермия.
- Алюмотермия ( алюминотермия)
Cr2O3 +2 Al 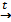 2Al2O3 + 2Cr
2Al2O3 + 2Cr
- Магниетермия.
Fe2O3 +3Mg 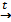 3MgO + 2Fe
3MgO + 2Fe
Можно проводить восстановление и другими веществами.
CuO + C → Cu + CO↑
NiO + H2 → Ni + H2O
2. Термическое разложение соединений металлов.
2AlH3 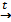 2Al + 3H2↑
2Al + 3H2↑
Fe(CO)5 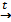 Fe + 5 CO ↑
Fe + 5 CO ↑
TiI4 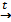 Ti + 2I2
Ti + 2I2
Этот метод применяется для получения высокочистых металлов.
3. Электролитическое получение металлов.
Металлы, особенно активные, можно получить при электролизе расплавов электролитов. Для щелочных металлов – это единственный способ их получения. Возможно получение металлов при электролизе водных растворов солей. Катионы металлов, расположенных в электрохимическом ряду напряжений до водорода, разряжаются на катоде в той или иной степени одновременно с молекулами воды. А в случае солей металлов, расположенных правее водорода, на катоде получается только соответствующий металл.
4. Более активный металл вытесняет менее активный из раствора его соли.
CuSO4 + Fe → FeSO4 + Cu
В таких реакциях нельзя использовать щелочные и щелочноземельные металлы, потому что они реагируют с водой.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|