
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Закон электролиза Фарадея. Закон электролиза: масса вещества, выделившегося на электродах прямо пропорциональна силе тока, идущего через электролит и времени прохождения тока (т.к. q=I.Δt, то: прямо пропорциональна заряду, прошедшему через электролит
Закон электролиза Фарадея
При электролизе на электродах происходит выделение вещества: 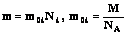
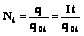
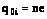 ,
,
где m0i и q0i - соответственно масса и заряд иона; М — молярная масса; Ni — число ионов, достигших электрода, n — валентность;
Таким образом, 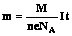 , но
, но 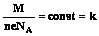 - электрохимический эквивалент вещества. Он зависит от рода вещества.
- электрохимический эквивалент вещества. Он зависит от рода вещества.
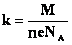
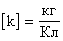
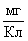
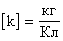
Следовательно, 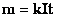
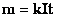
Запишем: 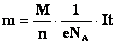
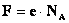
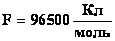
Обозначим 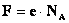 - число Фарадея
- число Фарадея
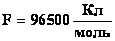
Физический смысл: Для выделения 1 моль одновалентного вещества необходимо пропустить через электролит заряд 96500 Кл.
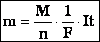
Закон электролиза: масса вещества, выделившегося на электродах прямо пропорциональна силе тока, идущего через электролит и времени прохождения тока (т.к. q=I.Δt, то: прямо пропорциональна заряду, прошедшему через электролит)
Определение заряда электрона
Из закона электролиза: 
Применение электролиза
Анодные процессы:
1. Промышленный способ получения кислорода и водорода.
2. Оксидирование алюминия
3. Электрополировка поверхностей. (электроискровая обработка, электрозаточка).
4. Электрогравировка.