
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Тема урока: Решение расчетных задач.
19.11.2021
Тема урока: Решение расчетных задач.
Цель урока: учащиеся смогут производить расчеты по уравнениям химических реакций.
Критерии успеха: учащиеся решают расчетные задачи на нахождение массы или объема продукта реакции по известной массе исходного вещества, содержащего примеси и рассчитывать практический выход продукта реакции по известной массе исходного вещества и массовой доле выхода продукта реакции.
Задача. Какой объем углекислого газа (н.у.) выделится при сжигании 500г угля, содержащего 8 % негорючих примесей. Найдите ошибку в решении задачи
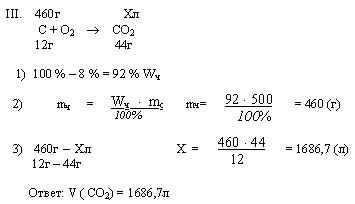
Решить самостоятельно задачи..
Задача №1. Вычислите массу хлорида кальция, полученного при взаимодействии соляной кислоты с оксидом кальция массой 50г, содержащего 5% примесей.
Задача № 1.Вычислите массу оксида кальция, который может быть получен при разложении карбоната кальция массой 5о кг, массовая доля примесей в котором составляет 20 %.
При сжигании углеводорода образуется 1,76 г. углекислого газа и 0,36 г воды. Относительная плотность данного вещества по кислороду равна 0,8125. Выведите формулу вещества.
Дано Решение
m(СО2)=1,76г По значениям масс углекислого газа и воды находим
m(Н2О)=0,36г массы углерода и водорода
D (поО2)=0,8125 44г СО2 -------- 12г С
СхНу -? 1,76г СО2 ------ хг С
х=1,76ּ12/44=0.48
18г Н2О -------- 2г Н
0,36г Н2О ------ хг С
х=0,36ּ2/18=0.04
С:Н=0.48/12:0.04/1
С:Н= 0.04:0.04
С:Н=1:1
М(СН)=12+1=13г/моль
М=D( О2)ּМ(О2)
М(СхНу)=0,8125ּ32=26г/моль
n=26/13=2
Ответ: С2Н2- ацетилен
В лаборатории из 33,6л ацетилена получили 30г бензола. Определите массовую долю выхода (в процентах) бензола от теоретически возможного.
Дано Решение
V(С2Н2)=33,6л Находим теоретический выход бензола
m(С6Н6)=30г 33,6л хг
η(С6Н6)-? 3С2Н2 → С6Н6
67,2л 78г
х=33,6ּ78/67,2=39г
Находим практический выход этилена
η=mпрак/mтеор; η(С6Н6)=30/39=0.77 или 77%
Ответ: η(С6Н6)=0.77 или 77%
Домашнее задание
Рассчитайте массу этилового спирта, который образуется при гидратации этилена объёмом 560 л. Массовая доля выхода спирта равна 92%. {Ответ: 1058 г.)
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|