
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Рисунок 1. Диаграмма элементного состава оксида ртути
Рисунок 1. Диаграмма элементного состава оксида ртути
Например, в состав оксида ртути HgО входят два элемента — ртуть и кислород. При нагревании 50 г этого вещества получается 46,3 г ртути и 3,7 г кислорода. Рассчитаем массовую долю ртути в сложном веществе:
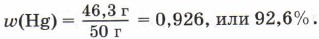
Массовую долю кислорода в этом веществе можно рассчитать двумя способами. По определению массовая доля кислорода в оксиде ртути равна отношению массы кислорода к массе оксида ртути:
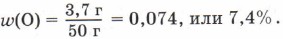
Зная, что сумма массовых долей элементов в веществе равна единице (100%), массовую долю кислорода можно вычислить по разности:
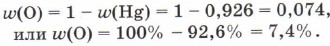
Для того чтобы найти массовые доли элементов предложенным способом, необходимо провести сложный и трудоемкий химический эксперимент по определению массы каждого элемента. Если же формула сложного вещества известна, та же задача решается значительно проще.
Для расчета массовой доли элемента нужно его относительную атомную массу умножить на число атомов данного элемента в формуле и разделить на относительную молекулярную массу вещества.
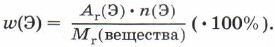
Например, для воды:

Давайте потренируемся в решении задач на вычисление массовых долей элементов в сложных веществах.
Задача 1. Рассчитайте массовые доли элементов в аммиаке, формула которого NH3.

Задача 2. Рассчитайте массовые доли элементов в серной кислоте, имеющей формулу H2SО4.

Чаще химикам приходится решать обратную задачу: по массовым долям элементов определять формулу сложного вещества.
То, как решаются подобные задачи, проиллюстрируем одним историческим примером.
Задача 3. Из природных минералов — тенорита и куприта (рис. 2) были выделены два соединения меди с кислородом (оксиды). Они отличались друг от друга по цвету и массовым долям элементов. В черном оксиде, выделенном из тенорита, массовая доля меди составляла 80%, а массовая доля кислорода — 20%. В оксиде меди красного цвета, выделенного из куприта, массовые доли элементов составляли соответственно 88,9% и 11,1%. Каковы же формулы этих сложных веществ? Решим эти две несложные задачи.

|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|