
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Химия. Группа 21 Занятие 10.
12.11.21. Химия. Группа 21 Занятие 10.
Тема занятия: «непредельные углеводороы – алкины.свойства, методы получения и применение».
Цель занятия: изучить свойства алкинов, их получение и применение.
Ход занятия.
Аиклические углеводороды, содержащие в молекуле помимо одинарных связей, одну тройную связь между атомами углерода и соответствующие общей формуле СпН2n-2.
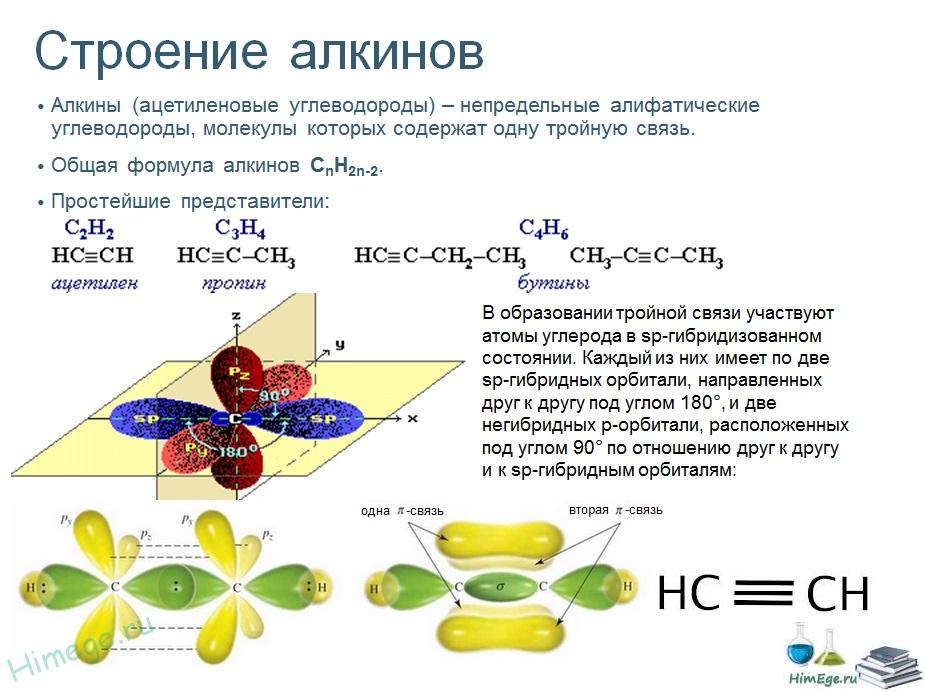 Атомы углерода, между которыми образована тройная связь, находятся в состоянии sр — гибридизации. Это означает, что в гибридизации участвуют одна s- и одна р-орбиталь, а две р-орбитали остаются негибридизованными. Перекрывание гибридных орбиталей приводит к образованию σ — связи, а за счет негибридизованных р-орбита-лей соседних атомов углерода образуются две π — связи.
Атомы углерода, между которыми образована тройная связь, находятся в состоянии sр — гибридизации. Это означает, что в гибридизации участвуют одна s- и одна р-орбиталь, а две р-орбитали остаются негибридизованными. Перекрывание гибридных орбиталей приводит к образованию σ — связи, а за счет негибридизованных р-орбита-лей соседних атомов углерода образуются две π — связи.
Таким образом, тройная связь состоит из одной σ -связи и двух π -связей.
Гомологический ряд этина
Неразветвленные алкинысоставляют гомологический ряд этина (ацетилена): С2Н2 — этин, С3Н4— пропин, С4Н6 — бутин, С5Н8 — пентин, С6Н10 — гексини т. д.
Изомерия и номенклатура алкинов
Для алкинов характерна структурная изомерия: изомерия углеродного скелета
и изомерия положения кратной связи. Простейший алкин, для которого характерны структурные изомеры положения кратной связи класса алкинов, — это бутин:
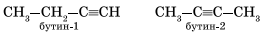
Изомерия углеродного скелета у алкинов возможна, начиная с пентина:
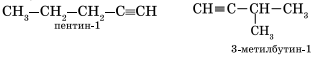
Так как тройная связь предполагает линейное строение углеродной цепи, геометрическая (цис-,транс-) изомерия для алкинов невозможна.
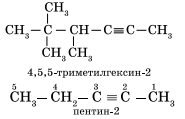
Наличие тройной связи в молекулах углеводородов этого класса отражается суффиксом — ин, а ее положение в цепи — номером атома углерода. Например:
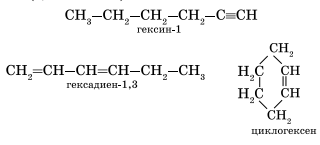
Алкинамизомерны соединения некоторых других классов. Так, химическую формулу С6Н10 имеют гексин (алкин), гексадиен (алкадиен) и циклогексен (циклоалкен):
Физические свойства алкинов
Температуры кипения и плавления алкинов, так же как и алкенов, закономерно повышаются при увеличении молекулярной массы соединений.
Алкины имеют специфический запах.
Они лучше растворяются в воде, чем алканы и алкены.
Химические свойства алкинов
Химические свойства алкинов сходны с алкенами, что обусловлено их ненасыщенностью.
1) p-Электроны более короткой тройной связи прочнее удерживаются ядрами атомов углерода и обладают меньшей поляризуемостью (подвижностью). Поэтому реакции электрофильного присоединения к алкинам протекают медленнее, чем к алкенам.
2) Связь атома водорода с углеродом в sp-гибридизованном состоянии значительно более полярна по сравнению с С-Н-связями в алканах и алкенах. Это объясняется различным вкладом в гибридизованное состояние s-орбитали, которая более прочно, чем р-АО, удерживает электроны. Чем больше вклад s-АО, тем выше способность атома удерживать внешние электроны, т.е. его электроотрицательность.
Повышенная полярность связи С(sp)-Н приводит к возможности ее гетеролитичес-кого разрыва с отщеплением протона Н+.
Таким образом, алкины с концевой тройной связью (алкины-1) проявляют кислотные свойства и способны, вступая в реакции с металлами, образовывать соли. 

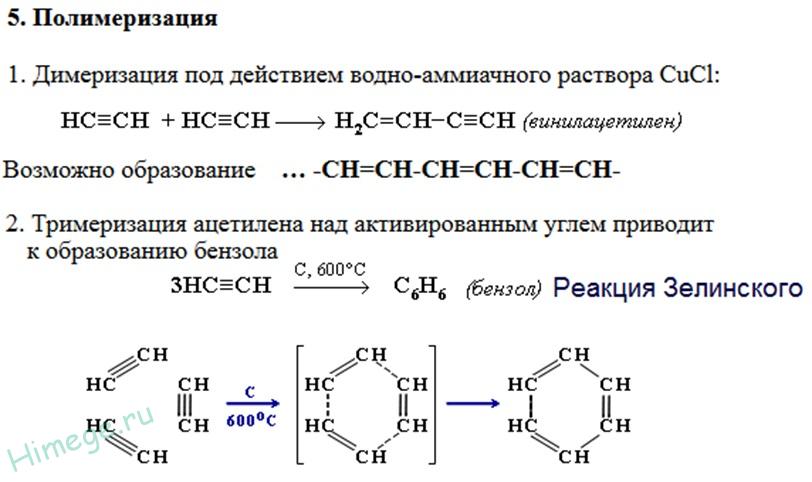


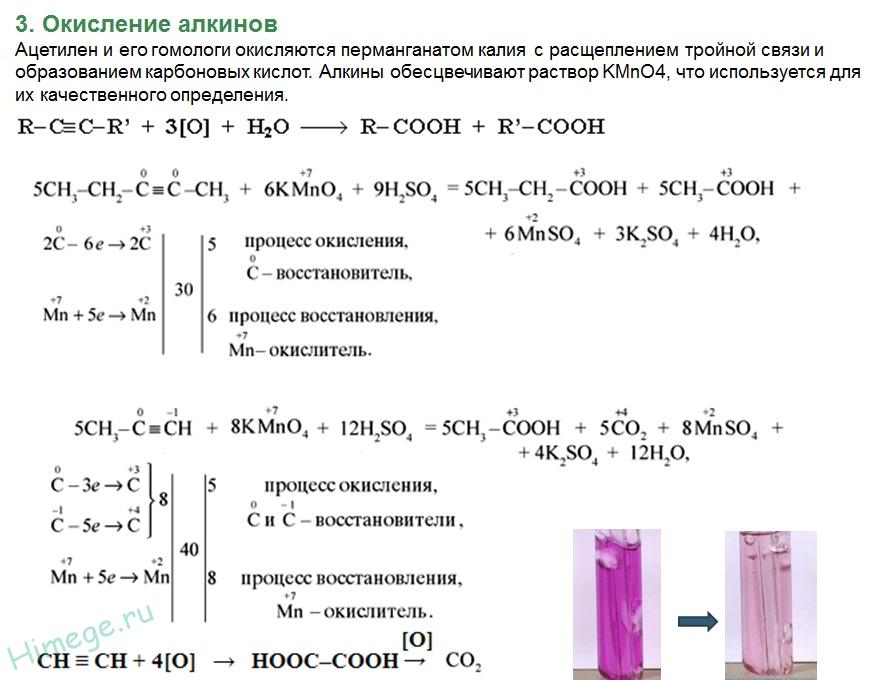

|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|