
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Ион-комплексообразователь. Устойчивость комплексных соединений. Номенклатура
Ион-комплексообразователь
Координационное число комплексообразователя (КЧ) – это количество атомов или их групп, которые связаны с комплексообразователем. (это число σ(сигма)-связей, подходящих к комплексообразователю от лигандов).
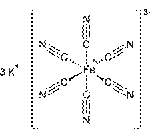 КЧ = 6
КЧ = 6
КЧ меняется от 1 до 12. Наиболее характерна следующая зависимость:
| Степень окисления комплексообразователя | КЧ |
| +1 | 2 (редко – 4) |
| +2 | 4 (может быть 6) |
| +3 |
Устойчивость комплексных соединений
Устойчивость комплексов в водных растворах зависит от прочности химических связей в комплексе. Устойчивость комплексов характеризуется константой устойчивости (иногда обратной величиной – константой нестойкости), которые изменяются в широких пределах.
В растворе: K[Ag(CN)2]→ K+ + [Ag(CN)2]-
[Ag(CN)2]- → Ag+ + 2 CN-
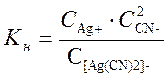
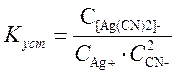
Чем меньше константа нестойкости, тем прочнее комплексный ион. Чем больше константа устойчивости, тем комплексный ион прочнее.
Номенклатура


Теории химической связи в комплексных соединениях:
1. Электростатическая теория (Коссель) – см. учебник Е.Г. Гончаров «Общая химия»
2.Теория валентных связей: см. учебник Е.Г. Гончаров «Общая химия»
3. Теория кристаллического поля (в след. Части 2)
4. ММО (в след. Части 2)
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|