
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Алгоритм определения массовой доли примесей по массе (объёму) продуктов реакции
Алгоритм определения массовой доли примесей по массе (объёму) продуктов реакции
| ПОСЛЕДОВАТЕЛЬНОСТЬ ДЕЙСТВИЙ | ПРИМЕР ВЫПОЛНЕНИЯ ДЕЙСТВИЙ |
| 1.Прочитайте текст задачи. | Определите массовую долю примесей в техническом образце карбида кальция, если из 200 г его получили 56 л ацетилена. |
| 2.Запишите условие и требование задачи с помощью общепринятых обозначений. |  2.Дано:
m (CaC2) = 200 г
V (C2H2) = 56 л 2.Дано:
m (CaC2) = 200 г
V (C2H2) = 56 л
  ωпримесей = ?
ωпримесей = ?
|
| 3.Запишите уравнение реакции | 3.Решение: CaC2 + 2Н2О = С2Н2 + Са(ОН)2 |
| 4. Пусть Х – масса чистого карбида кальция. Над формулой ацетилена запишите то, что дано в условии задачи | Х г 56 л CaC2 + 2Н2О = С2Н2 + Са(ОН)2 |
| 5. Под уравнением записываем то, что следует из уравнения реакции с учётом условий задачи (массу аммиака и объём оксида азот (П) | Mr (CaC2) = Ar(Ca) + 2Ar(C) = 40 + 2 · 12 = 64 M (CaC2) = 64 г/моль m (CaC2) = 1 моль · 64 г/моль = 64 г V (С2Н2) = ν (С2Н2) · Vm = 1 моль · 22,4 л/моль = 22,4 л Х г 56 л CaC2 + 2Н2О = С2Н2 + Са(ОН)2 64 г 22,4 л |
| 6. Составьте пропорции и определите практическую массу карбида кальция . | 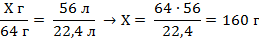
|
| 7. Определяем массу примесей | m(примесей) = 200 г – 160 г = 40 г |
| 8. Определяем массовую долю примесей | 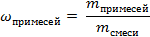
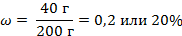
|
| 9.Запишите ответ. | Ответ: 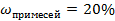
|
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|