
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
AD + BC → AC + BD.
№1.
Оптически активное вещество – вещество, обладающее оптической стереоизомерией. Оптическая стереоизомерия обусловлена наличием в молекуле асимметрических атомов углерода, т.е атомов углерода, связанных с четырьмя различными группами.

5·| C–1 – 4e– → C+3 окисление
4·| Mn+7 + 5e– → Mn+2 восстановление.
№2.
Пусть в результате реакций образовалось соответственно 2 моль NO2 и 1 моль NO.
Cu + 4 HNO3(конц) = Cu(NO3)2 + 2 NO2 + 2 H2O, (1)
Количества веществ реакции (1) 1 4 Стало: 2
3 Cu + 8 HNO3 = 3 Cu(NO3)2 + 2 NO + 4 H2O, (2)
Количества веществ реакции (2) 1,5 4 Стало: 1
С 2,5 моль Сu реагируют 8 моль HNO3. Значит, с 1 моль Cu реагирует 8/2,5 = 3,2 моль HNO3.
Ответ: 3,2 моль HNO3.
№3.
Пусть необходимо добавить х моль Na2SO4·10H2O, тогда m(Na2SO4·10H2O) = 322х г.
m(BaCl2 исходный) = 60·0,3 = 18 (г),
n(BaCl2 исходный) = 18/208 = 0,0865 (моль),
По условию BaCl2 был в избытке.
Было: х 0,0865
Na2SO4·10H2O + BaCl2 = BaSO4↓ + 2 NaCl + 10 H2O + (BaCl2),
х х Стало: х 0,0865 – х
m(BaSO4) = 233х г.
m(конечного раствора) = 60 + 322х – 233х = 60 + 89х (г),
m(BaCl2) = 18 – 208х г,
w(BaCl2) = 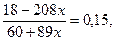
18 – 208х = 9 + 13,35х, 9 = 221,35х, х = 0,04066,
m(Na2SO4·10H2O) = 0,04066·322 = 13,09 (г).
Ответ: m(Na2SO4·10H2O) = 13,09 г.
№4.
Степенью диссоциации a электролита называется доля его молекул, подвергшихся диссоциации, т.е отношение числа молекул, распавшихся в данном растворе на ионы, к общему числу молекул электролита в растворе.
CH3COOH ↔ CH3COO– + H+
Было: c
Прореаг: ac
Стало: c(1 – a) aс ac
Kдисс. = 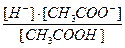
Kдисс. = 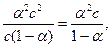 (закон разбавления Оствальда).
(закон разбавления Оствальда).
K1 = 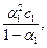 K2 =
K2 = 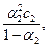

а) Степень диссоциации уксусной кислоты значительно меньше единицы, в приближённых вычислениях можно считать, что 1 – a » 1, тогда
K1 = K2, 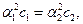 a2 = 4a1,
a2 = 4a1,

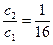 , значит, раствор необходимо разбавить в 16 раз.
, значит, раствор необходимо разбавить в 16 раз.
Ответ: разбавить в 16 раз.
б) 1-ый способ.
[H+1] = a1c1. [H+2] = a2c2 = 4a1·  c1 = 0,25a1c1,
c1 = 0,25a1c1,
pH = –lg[H+],
pH2 – pH1 = lg[H+1] – lg[H+2] = lg(a1c1) – lg(0,25a1c1) = 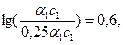
2-ой способ.
K(CH3COOH) = 1,8·10–5,
Пусть исходный раствор концентрации 1 моль/л, тогда второй раствор концентрации (1/16) моль/л,
[H+] = aс
K = a2c, a = 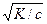 ,
,
[H+] = 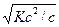 =
=  ,
,
[H+1] = 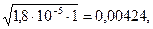
[H+2] = 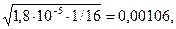
pH2 – pH1 = lg[H+1] – lg[H+2] = –2,37 + 2,97 = 0,6.
Ответ: ∆pH = 0,6. 
№5.
Предположим, что загаданные соли не являются ни кислыми, ни основными, ни двойными, ни смешанными, ни комплексами. Все соли неорганические и средние.
AC → AD + Х (1)
Пусть A – катион, тогда, исходя из реакции (1), С – анион и D – анион.
AD + BC → AC + Y + … (2)
Исходя из реакции (2), у соли BC C – анион, а B – катион.
По реакции (2) катион B и анион D попадает в состав газа Y. В этом случае катионом B может быть или H+ или NH4+. Но B – не кислота, и мы загадали, что все соли средние, а не кислые. Значит B – NH4+. Выходит, в состав газа Yвходит азот. Это могут быть NH3, N2, N2O, NO, NO2. Другие варианты сомнительны. Попытаемся установить, какой из этих газов есть Y, зная, что М(X) = 1,143 М(Y).
Если Y – NH3, то М(Х) = 1,143·17 = 19,43 (г/моль) – такого газа нет.
Если Y – N2, то M(X) = 1,143·28 = 32 (г/моль) – это O2.
Если Y – N2O, то M(X) = 1,143·44 = 50,292 (г/моль) – такого газа нет.
Если Y – NO, то M(X) = 1,143·30 = 34,29 (г/моль) – такого газа нет.
Если Y – N2O3, то M(X) = 1,143·46 = 52,578 (г/моль) – такого газа нет.
Вывод: Y – N2, X – O2. Азот мог образоваться по реакции (2) в результате разложения образовавшегося вначале промежуточного продукта – NH4NO2.
AD + BC → AC + BD.
Этот промежуточный продукт – BD, значит, если B – NH4+, то D – NO2–.
Соль AD – нитрит. Она образуется разложением нитрата с образованием O2. C – NO3–.
Возможный вариант решения.
2 NaNO3 (AC) = 2 NaNO2 (AD) + O2 (X),
NaNO2 (AD) + NH4NO3 (BC) = NaNO3 (AC) + N2 (Y) + H2O.
Ответ: AC – NaNO3, AD – NaNO2, BC – NH4NO3.
№6.
CnH2n+1COOH + CH3OH → CnH2n+1COOCH3 + H2O,
5х
Сn+1H2n+3COOH + CH3OH → Cn+1H2n+3COOCH3 + H2O,
х
Пусть n(CnH2n+1COOH) = 5х моль, n(Сn+1H2n+3COOH) = х моль.
M(CnH2n+1COOH) = 14n + 46 г/моль,
m(CnH2n+1COOH) = (14n + 48)5х = (70n + 230)х (г),
M(Сn+1H2n+3COOH) = 14n + 60 г/моль,
m(Сn+1H2n+3COOH) = (14n + 60)х (г),
m(исходной смеси кислот) = (70n + 230 + 14n + 60)х = 37,4 (г),
84n + 290 = 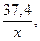
M(CnH2n+1COOCH3) = 14n + 60 г/моль,
M(Cn+1H2n+3COOCH3) = 14n + 74 г/моль,
Неизвестно, выход какого эфира составил 50%, а какого – 70%.
Пусть у CnH2n+1COOCH3 был выход 50%, а у Cn+1H2n+3COOCH3 – 70%.
m(CnH2n+1COOCH3) = 2,5х·(14n + 60) = (35n + 150)x (г),
m(Cn+1H2n+3COOCH3) = 0,7х·(14n + 74) = (9,8n + 51,8)х (г),
m(смеси эфиров) = (35n + 150 + 9,8n + 51,8)x = (44,8n + 201,8)х = 30,3 (г),
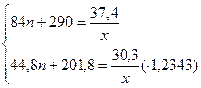
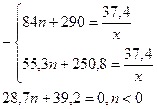
Значит, предположение было неверным.
Выход CnH2n+1COOCH3 – 70%, выход Cn+1H2n+3COOCH3 – 50%,
m(CnH2n+1COOCH3) = 3,5х(14n + 60) = (49n + 210)х (г),
m(Cn+1H2n+3COOCH3) = 0,5х(14n + 74) = (7n + 37)х (г),
m(смеси эфиров) = (49n + 210 + 7n + 37)х = (56n + 247)x = 30,3 (г),


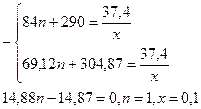
n(CH3COOH) = 0,5 моль, n(С2H5COOH) = 0,1 моль.
m(CH3COOH) = 0,5·60 = 30 (г),
m(C2H5COOH) = 37,4 – 30 = 7,4 (г),
w(CH3COOH) = 30·100%/37,4 = 80,21%,
w(C2H5COOH) = 7,4·100%/37,4 = 19,79%.
Ответ: w(CH3COOH) = 80,21%, w(C2H5COOH) = 19,79%.
№7.
2 (NH4)2CrO4 = N2 + 2 NH3 + Cr2O3 + 5 H2O, (1)
х 0,5х х 0,5х
(NH4)2Cr2O7 = N2 + Cr2O3 + 4 H2O, (2)
у у у
Cr2O3 + 2 KOH = 2 KCrO2 + H2O, (3)
KCrO2 + CO2 + 2 H2O = Cr(OH)3 + KHCO3, (4)
n[Cr(OH)3] = 2,06/103 = 0,02 (моль),
По реакциям (3) и (4) n(Cr2O3) = 0,01 моль,
Пусть в исходной смеси n[(NH4)2CrO4] = х моль, n[(NH4)2Cr2O7] = у моль,
Значит, n(Cr2O3) = 0,5х + у = 0,01 моль, (*)
C соляной кислотой реагирует только аммиак.
NH3 + HCl = NH4Cl, (5)
Из условий следует, что количество вещества аммиака равно количеству вещества N2.
По реакциям (1) и (2) n(NH3) = х моль, n(N2) = 0,5х + у моль,
х = 0,5х + у, х = 2у,
Подставим х = 2у в уравнения (*):
2у = 0,01, у = 0,005, х = 0,01.
m[(NH4)2CrO4] = 0,01·152 = 1,52 (г),
m[(NH4)2Cr2O7] = 0,005·252 = 1,26 (г),
m(смеси) = 1,52 + 1,26 = 2,78 (г).
Ответ: m(смеси) = 2,78 г.
№8.
Изменение давления газовой равновесной смеси не влияет на константу равновесия. Однако изменение давления влияет положение равновесия.
Уравнения константы равновесия:
Кравн. = 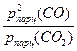 , где все давления в атмосферах,
, где все давления в атмосферах,
Парциальное давление газа – давление, которое производил бы газ, занимая при тех же условиях объём всей газовой смеси.
Парциальные давления зависят от общего давления P следующим образом.
p1 = c1P, где c1 – мольная доля газа в смеси.
Кравн. = 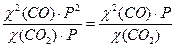
Kравн. = 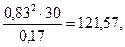
а) Кравн. = 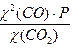 =
= 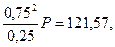
2,25P = 121,57, P = 54,
Ответ: Р = 54 атм.
б) c(CO) = х,
Кравн. = 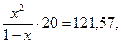
х2 = 6,0785 – 6,0785х,
х2 + 6,0785х – 6,0785 = 0,
D = 6,07852 + 4·6,0785 = 61,26,
х = 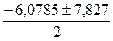 х = 0,8743,
х = 0,8743,
c(CO2) = 1 – 0,8743 = 0,1257.
Ответ: c(CO2) = 12,57%.
в) CO2 (г) + С (тв) ↔ 2 CO (г),
Кравн. = 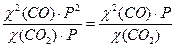 =
= 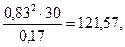
Пусть исходная смесь находилась в объёме 1 м3.
PV = nRT, n = (PV)/(RT),
n(смеси) = 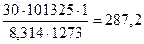 (моль),
(моль),
n(CO2 в смеси с содержанием 17%) = 287,2·0,17 = 48,83 (моль),
n(CO в смеси с содержанием 17%) = 287,2 – 48,83 = 238,37 (моль),
Эквивалентное количество CO2:
n(CO2) = 48,83 + (238,37/2) = 168 (моль),
При данных условиях добавили:
n(N2) = 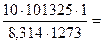 95,73 (моль),
95,73 (моль),
При этом установилось равновесие: CO2 (г) + С (тв) ↔ 2 CO (г), N2
Было: 168
Прореаг: х
Стало: 168 – х 2х 95,73,
n(общей смеси в установившемся равновесии) = 168 – х + 2х + 95,73 = 263,73 + х (моль),
n(CO2) = 168 – х моль.
c(CO2) =  ,
,
n(CO) = 2х моль,
c(CO) = 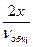 ,
,
Кравн. = 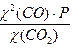 =
= 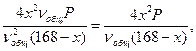
pV = nRT, 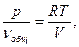
Кравн. = 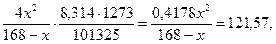
0,4178х2 = 20423,76 – 121,57х,
х2 + 290,98х – 48884 = 0,
х = 119,
c(CO2) = 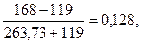
0,17/0,128 = 1,33.
Ответ: уменьшится в 1,33 раза.
№9.
Возраст Земли – это время, прошедшее после нуклеосинтеза.
m(238U) – масса изотопа урана-238 в наши дни.
m(235U) – масса изотопа урана-235 в наши дни.
m0 – исходная масса изотопов.
m(238U) = m0· 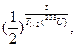
m(235U) = m0· 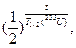
Найдём отношение масс изотопов в наши дни:
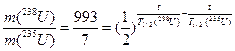
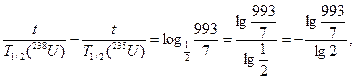
t =  6 млрд лет.
6 млрд лет.
Ответ: t = 6 млрд лет.
№10.
Заметим следующее повторение в схеме превращений:
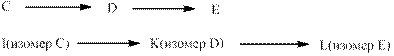
Такое возможно, если аминогруппа занимает в аминокислотах E и L разные положения. На основании этого возможное решение цепочки:
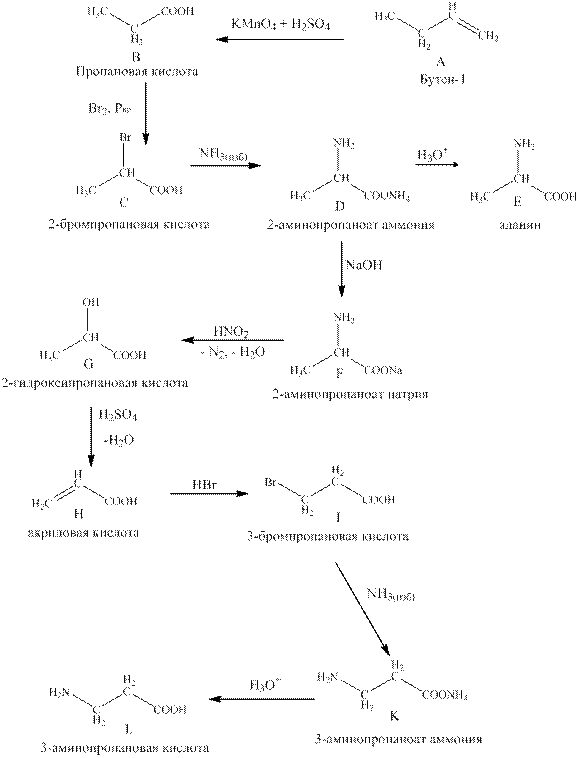
Уравнение реакций:
1) CH3CH2CH=CH2 + 2 KMnO4 + 3 H2SO4 → CH3CH2COOH + CO2 + K2SO4 + 2 MnSO4 + 4 H2O,
С–1 – 4e–→ C+3
C–2 – 6e–→C+4
2 Mn+7 + 10e– → 2 Mn+2
2) CH3CH2COOH + Br2 Pкр→ CH3CHBrCOOH + HBr (реакция Геля-Фольгарда-Зелинского)
3) 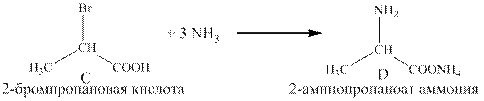
4) CH3CH(NH2)–COONH4 + H2O (H+) → CH3CH(NH2)–COOH + (NH3·H2O)
Условие реакции: При обработке 2-бромпропановой кислоты раствором кислоты, например HCl, образуется CH3CH(NH3+Br–)–COOH. Этот побочный продукт требует дополнительной обработки пиридином:
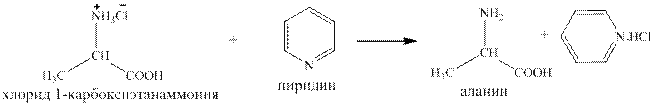
5) CH3CH(NH2)–COONH4 + NaOH → CH3CH(NH2)–COONa + (NH3·H2O),
6) CH3CH(NH2)–COONa + NaNO2 + 2 HCl → CH3CH(OH)–COOH + N2 + H2O + 2 NaCl (реакция Ван-Слайка)
7) 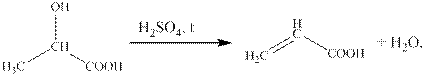
8) CH2=CH–COOH + HBr → CH2Br–CH2–COOH,
9) 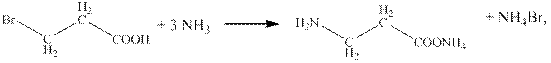
10) NH2CH2CH2COONH4 + H2O (H+) → NH2CH2CH2COOH + (NH3·H2O).
№11.
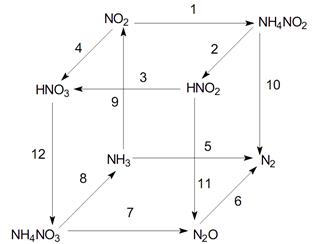
1) 2 NO2 + 2 (NH3·H2O)(конц) → NH4NO3 + NH4NO2 + H2O,
2) NH4NO2 + HCl(разб) = NH4Cl + HNO2, (условия 0оС)
3) 3 HNO2 → HNO3 + 2 NO + H2O
Условия реакции: температура выше 100oС. Реакция проходит при перегонке азотистой кислоты.
4) 4 NO2 + O2 + 2 H2O → 4 HNO3,
По этой реакции азотная кислота образуется при грозовых разрядах.
5) 2 NH3  N2 + 3 H2,
N2 + 3 H2,
Условия реакции: высокий температурный режим.
6) N2O 200°C→ 2 N2 + O2,
7) NH4NO3 200°C→ N2O + 2 H2O,
8) NH4NO3 + NaOH → NaNO3 + NH3↑ + H2O,
9) 2 NH3 + 3 O3 100°C→ 2 NO2 + O2 + 3 H2O,
Условия реакции: в этой реакции образуется N2O5, который при данной распадается на NO2 и O2.
10) NH4NO2 100°C→ N2 + 2 H2O,
11) HNO2 + NH2OH 50°C→ N2O + 2 H2O,
12) 4 Ca + 10 HNO3 (разб) = 4 Ca(NO3)2 + NH4NO3 + 3 H2O,
Баланс:
4·|Ca0 – 2e– → Ca2+,
1·|N+5 + 8e– → N–3,
(NH3·H2O) + HNO3 = NH4NO3 + H2O.
№12.
Для призмана можно построить только одно монометилпроизводное:
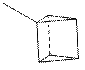
Возможно, ошибка Ладенбурга состоит в том, что он не учёл существование зеркального изомера для одного из диметилпроизводных призмана.
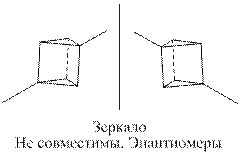


Таким образом, для призмана возможны одно монометилпроизводное (как у бензола) и 4 диметилпроизводных.
№13.
Углеводород Х: n(C) : n(H) =  :
: 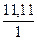 = 7,4075 : 11,11 = 1 : 1,5 = 2 : 3.
= 7,4075 : 11,11 = 1 : 1,5 = 2 : 3.
Соединение Z: n(C) : n(O) = 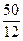 :
: 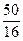 = 4,166 : 3,125 = 4 : 3.
= 4,166 : 3,125 = 4 : 3.
Х – ароматическая структура, потому что:
1) Соединение C : H = 2 : 3, это соединение С4H6 и другие алифатические или алициклические соединения с большим количеством атомов С, которые могут давать много моно- и ди-хлорпроизводных и бромпроизводных.
2) Селективная реакция с галогенами в зависимости от того, используется катализатор железо или нет.
3) После окисления и нагревания была получена структура, не содержащая атомов водорода, и это не CO2. Такое возможно для ароматических и сомнительно для алифатических соединений.
Из п.3 следует, что Х – ароматическая структура, замещённая по всем положениям.
После таких выводов можно начинать осознанный перебор для соединения Х:
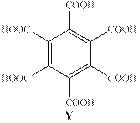
C4H6 – не ароматическая структура. C6H9 – не существует. С8H12 – не ароматическая структура (СnH2n–4). С10H15 – не существует. C12H18 – именно эта формула удовлетворяет всем условиям в виде следующей структуры.
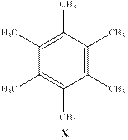
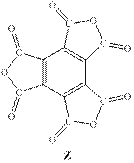
Действительно, после окисления X все алкильные группы превратятся в карбокси-группы с образованием бензолгексакарбоксильной кислоты (С12H6O12). При нагревании происходит отщепление 3-ёх молекул воды с образование C12O9, что удовлетворяет структуре Z. (Смотри реакции ниже)

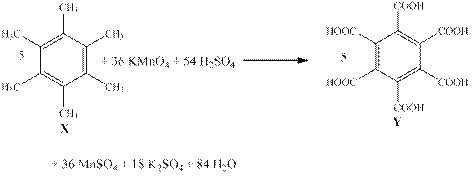
5·| 6 C–3 – 36e– → 6 C+3
36·| Mn+7 + 5e– → Mn+2
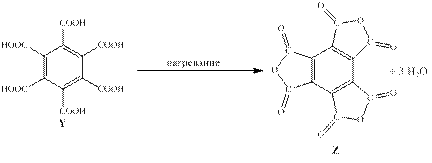
Ответ:

|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|