
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Разбор задач к первому коллоквиуму 1 семестра
Разбор задач к первому коллоквиуму 1 семестра
Билет № 21 (дополнительный)
Задание повышенной сложности на оценку 5++ (после ответа по билетам).
В систему объемом 40 л ввели 4 моль красного фосфора (Р) и 5,5 моль хлора (Cl2). Систему нагрели до 214 °С. В ней установилось равновесие
P4 + 6Cl2 = 4PCl3 (все вещества – газы),
а равновесное давление газа составило 5 атм.
Найти равновесные количества всех молекулярных форм в системе (P4, Cl2, PCl3) и константу равновесия KP при данной температуре.
Решение
Обозначим за x¢, y¢ и z¢ давления паров P4, Cl2 и PCl3 соответственно.
За x, y и z обозначим числа молей P4, Cl2 и PCl3 соответственно.
Тогда по закону Дальтона получаем
x¢ + y¢ + z¢ = P, (1)
где P – общее давление в системе.
Запишем закон сохранения по фосфору. Этот закон показывает, что число атомов фосфора до и после реакции остается неизменным.
Для этого закона получаем 4x + 0y + z = B или
4x + z = B (2)
где B – число молей фосфора в расчете на атомы. (У нас B = 4 мол.).
Аналогично для закона сохранения по (атомам) хлора. Имеем:
0x + 2y + 3z = C, где С – число молей атомов хлора. Последних вдвое больше, чем исходных молекул хлора (У нас С = 5,5×2 = 11 мол.) Итак
2y + 3z = C (3)
Если бы уравнение (1) содержало числа молей, а не давления, то мы бы получили систему из трех уравнений с тремя неизвестными. Однако от парциальных давлений к числам молей легко перейти, если уравнение (1) умножит на величину (V/RT). Тогда, согласно закону идеального газа получаем
x + y + z = PV/RT, (1¢)
где P – общее давление в системе. Обозначая для краткости записи
PV/RT = A, получаем систему из трех уравнений с тремя неизестными x, y и z.
В нашем случае A = 5×101325×40×0,001/(8,314×(273+214)) » 5
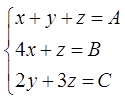 (4)
(4)
Или в нашем случае
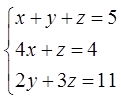 (5)
(5)
Решение системы дает:
x = n(P4) = ½ мол.;
y = n(Cl2) = 2,5 мол.;
z = n(PCl3) = 2 мол.
Соответствующие величины парциальных давлений вычислим, также исходя из уравнения идеального газа:
pi = niRT/V или
p(P4) = ½×8,314×(273+214)/0,04 » 50000 Па » 0,5 атм;
p(Cl2) = 2,5 атм;
p(PCl3) = 2 атм.
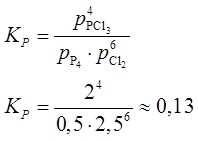 .
.
Билет №12
2. Известно, что при стандартном давлении и любых температурах a-карбин
(–СºС–)n является метастабильной фазой углерода и самопроизвольно превращается в графит. Известно, что озон разлагается до О2 также со значительным тепловыделением. Доказать, что реакция
3Скарбин + 2O3газ = 3CO2газ
сопровождается большим выделением теплоты (в расчете на одно и то же количество газообразного СО2), чем реакция между графитом и кислородом в тех же условиях. Принять, что энтропии графита и карбина одинаковы.
Решение
Запишем цикл согласно закону Гесса.
DrH1

 Скарбин + 2/3O3газ CO2газ
Скарбин + 2/3O3газ CO2газ
DrH3 (< 0) DrH2
DrH4 (< 0)
 Сграфит (+2/3O3) 2/3O3газ O2газ (+Сграфит)
Сграфит (+2/3O3) 2/3O3газ O2газ (+Сграфит)
Исходя из полученного цикла получаем:
DrH1 = DrH2 + DrH3 + DrH4.
Т.к. DrH3 и DrH4 < 0, то DrH1 имеет более отрицательное значение, чем DrH2.
Это значит, что в одинаковых условиях тепловыделение Q1 > Q2. Что и требовалось доказать.
Теперь докажем строго, что DrH3 действительно < 0.
DrG3 < 0.
Это по условию задачи (раз процесс самопроизвольный в закрытой системе).

 DrG3 = DfGграфит – DfGкарбин = DfHграфит – T×Sграфит – DfHкарбин + T×Sкарбин
DrG3 = DfGграфит – DfGкарбин = DfHграфит – T×Sграфит – DfHкарбин + T×Sкарбин
Отсюда DrG3 < 0 возможно только при DfHграфит – DfHкарбин < 0.
Но DfHграфит – DfHкарбин = DrH3.
Билет № 18
1. Гомогенные и гетерогенные равновесия.
2. Рассчитайте тепловой эффект образования гексагидрата нитрата магния Mg(NO3)2×6H2O, если известны следующие данные:
Mg(мет.) + 2H+(p-p) = Mg2+(p-p) + H2; DH1 = –465,8 кДж/моль;
H2 +N2 + 3O2 = 2H+(p-p) + NO3–(p-p) DH2 = –409,4 кДж/моль;
Mg(NO3)2×6H2O = Mg2+(p-p) + NO3–(p-p) + 6H2O(ж.) DH3 = +21,3 кДж/моль;
H2 + ½O2 = H2O(ж.) DH4 = –285,8 кДж/моль.
Если агрегатное состояние вещества не указано, считать его газом.
Решение
Запишем цикл согласно закону Гесса.
DrH0


 Mg + N2 + 3O2 + 6(H2+½O2) Mg(NO3)2×6H2O
Mg + N2 + 3O2 + 6(H2+½O2) Mg(NO3)2×6H2O
DrH1 + 2H+(p-p)
 Mg2+(p-p) + H2 {+ N2 + 3O2 + 6(H2+½O2)}
Mg2+(p-p) + H2 {+ N2 + 3O2 + 6(H2+½O2)}
DrH2 H2 +N2 + 3O2 = 2H+(p-p) + NO3–(p-p) (+ Mg2+)
 2H+(p-p) + NO3–(p-p) (+ Mg2+) {+ N2 + 3O2 + 6(H2+½O2)}
2H+(p-p) + NO3–(p-p) (+ Mg2+) {+ N2 + 3O2 + 6(H2+½O2)}
6×DrH4 6(H2 + ½O2) = 6H2O(ж.) {2H+(p-p) + NO3–(p-p) + Mg2+)}
 6H2O(ж.) {2H+(p-p) + NO3–(p-p) + Mg2+)}
6H2O(ж.) {2H+(p-p) + NO3–(p-p) + Mg2+)}
–DrH3 Mg2+(p-p) + NO3–(p-p) + 6H2O(ж.) {2H+(p-p)}
 Mg(NO3)2×6H2O {+2H+}
Mg(NO3)2×6H2O {+2H+}
Итого: DrH0 = DrH1 + DrH2 +6DrH4 – DrH3
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|