
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Гидролиз крахмала
1. Предмет и задачи пищевой химии. Понятия о пищевой и биологической ценности продуктов.
Пищевая химия – один из разделов химической науки, её основной предмет – это область питания человека. Пищевая химия занимается вопросами химического состава пищевых продуктов, преобразований нутриентов в технологическом потоке и в нашем организме, разработкой новых методов анализа и системы управления качеством. Среди основных проблем, стоящих перед обществом, является обеспечение населения продуктами питания, так как от состава и качества продуктов питания, зависит обеспеченность нашего организма пластическим материалом и энергией, работоспособность, здоровье, способность человека к воспроизводству. Одной из важнейших причин ухудшения показателей здоровья населения во всём Мире на сегодняшний день является неудовлетворительное, неполноценное питание. Таким образом, организация здорового питания населения – сложный процесс, зависящий от экологической обстановки, обеспеченности населения, достижений медицины, фундаментальных наук (физика, химия, микробиология), новых технологических возможностей, которые появились у производителей продуктов питания. Эти направления в значительной степени охватываются областью науки – пищевая химия.
Пищевая ценность – понятие, отражающее всю полноту полезных свойств пищевого продукта, включая степень обеспечения физиологических потребностей в основных пищевых веществах, энергию и органолептические достоинства. Характеризуются химическим составом пищевого продукта с учетом его потребления в общепринятых количествах.
Биологическая ценность – показатель качества пищевого белка, отражающий степень соответствия его аминокислотного состава потребностями организма в аминокислотах для синтеза белка
2. Общая характеристика пищевых продуктов, их классификация. Современные требования, предъявляемые к пищевым продуктам.
Пищевые продукты – объекты окружающей среды и продукты их переработки, которые используются человеком в качестве источника энерг в-в, в том числе незаменимых питательных веществ.
Классификация продуктов питания:
- продукты массового назначения (традиционные и новые)
- функцион-е продукты массового назначения (с добавлением полезных свойств, обогащенные витаминами, пищевыми волокнами)
- специального назначения для отдельных категорий населения
- продукты для детей, беременных и кормящих
- лечебные продукты
Продукты питания должны удовлетворять потребности человека в пищевых веществах и энергии, а также выполнять профилактические и лечебные функции. На решение этих задач направлена концепция государственной политики в области здорового питания населения нашей республики.
Качество продукции – это совокупность свойств и характеристик продукции, которые придают продукции способность удовлетворять обусловленные или предполагаемые потребности, то есть высокие органолептические показатели, удовлетворение потребности организма в основных пищевых веществах (нутриентах) и обеспечение безопасности для здоровья человека.
Безопасность пищевых продуктов – состояние обоснованной уверенности в том, что пищевой продукт в обычных условиях его использования не является вредным и не представляет опасности для здоровья нынешнего и будущих поколений.
3. Состояние питания населения России. Основные пути увеличения продуктов питания и улучшения их качества.
История показывает, что проблема пищи всегда являлась одной из наиболее важных.
Более 60 % людей сегодня не получают должного количества пищи, в первую очередь – белка.
Постоянное недоедание приводит к снижению умственных способностей, физическому истощению, резкому снижению общего иммунитета. Однако голод может наступить и в процветающей стране, т.к. покупательная способность людей различна. Среди основных проблем, стоящих перед человеческим обществом в наше время является:
- обеспечение населения земного шара продуктами питания;
- обеспечение энергией;
- обеспечение сырьем, в том числе водой;
- охрана окружающей среды;
Самой важной и самой сложной является обеспечение продуктами питания. Состояние питания является одним из важнейших факторов, определяющих здоровье нации. Продукты питания должны не только удовлетворять потребностям человека в основных питательных веществах и энергии, но и выполнять профилактические и лечебные функции.
Основные нарушения пищевого статуса россиян:
-избыточное потребление животных жиров
-дефицит полиненасыщенных жк
- дефицит полноценных белков
- дефицит пищ волокон
- дефицит витаминов, микроэлементов
4. Биологические функции аминокислот.
Аминокислоты – это первичные структурные блоки молекулы белка. С химической точки зрения аминокислоты являются амфотерными соединениями, так как в одной молекуле аминокислоты содержатся как минимум две функциональные группы основная (амино-) и кислотная (карбоксо-), которые при взаимодействии друг с другом образуют, так называемые пептидные связи. Из 300 известных аминокислот в пищевых продуктах для человека существенную роль играют 20.
Аминокислоты отличаются друг от друга структурой боковых цепей, от которой зависят химические, физические свойства и физиологические функции, образуемых ими белков.
Серин содержит активную гидроксильную группу; он входит в состав ряда гидролитических ферментов (трипсина, химотрипсина). Валин необходим для восстановления поврежденных тканей. Может быть использован мышцами в качестве источника энергии. Лизин – способствует росту костной ткани усвоению кальция. триптофан участвует в образовании гемоглобина, сывороточных белков, никотиновой кислоты.
5. Участие аминокислот в обмене веществ и технологических процессах.
Ежесуточно 40 г белка из 6 кг, составляющих белковый "фонд" организма, подвергается распаду до конечных продуктов и должно быть возмещено эквивалентным количеством вновь образованных белков за счет биосинтеза из аминокислот. Так как резерва аминокислот в организме нет, то они должны поступать в составе белков пищи. 10 аминокислот из двадцати, входящих в состав белков могут синтезироваться в организме из углеводородных фрагментов в реакции аминирования. Это заменимые аминокислоты аланин, глицин, аспарагиновая кислота, глутаминовая кислота, аспарагин, глутамин, тирозин, серин, цистеин, пролин. Восемь аминокислот незаменимые, их углеводородные фрагменты не синтезируются в животном организме, поэтому эти кислоты должны поступать в составе белков корма. Это валин, лейцин, изолейцин, метионин, треонин, лизин, фенилаланин, триптофан (аргинин, гистидин частично незаменимые для взрослых животных и незаменимые для молодняка). Условно незаменимыми являются тирозин и цистеин, так как для их синтеза необходимы незаменимые аминокислоты фенилаланин и метионин.
В зависимости от аминокислотного состава различают полноценные и неполноценные белки. Неполноценным белком считается такой, который не содержит хотя бы одной незаменимой аминокислоты. Полноценными белками являются белки животного происхождения, неполноценные являются растительные белки. Если белок содержит все незаменимые аминокислоты в необходимых пропорциях и легко подвергается действию протеолитических ферментов, то он считается полноценным и его биологическая ценность такого белка условно принимается за 100 единиц (белки яиц, молока). Белки говядины имеют биологическую ценность 98, белки кукурузы 36. растительные белки бедны метионином, триптофаном, лизином.
Несбалансированность аминокислот в рационе пагубно влияет на детей, люди старших возрастных групп имеют сложившиеся ферментные системы, позволяющие выводить из организма токсичную аминокислоту. Последствия нарушения белкового обмена у детей практически невозможно устранить какими-либо способами.
Недостаток диаминомонокарбоновых кислот аргинина и лизина приводит к снижению скорости синтеза основных белков, формирующих хроматин хромосом протаминов и гистонов. Замедляется рост, наблюдается нарушение функции двигательного аппарата, вплоть до паралича.
Недостаток серусодержащих аминокислот метионина, цистеина замедляет синтез белков соединительной ткани коллагена и кератина.
При недостаточном содержании триптофана кроме снижения скорости синтеза различных белков, возникает авитаминоз никотиновая кислота, так как она может синтезироваться из этой аминокислоты.
Лейцин. Относительный избыток его по сравнению с другими незаменимыми аминокислотами угнетает рост из-за соответствующего нарушения усвоения изолейцина.
Гистидин. Недостаток его сопровождается снижением концентрации гемоглобина.
Метионин. Исключение его из пищи сопровождается жировым перерождением печени, обусловленным недостатком лабильных метальных групп для синтеза лецитина.
Валин. Недостаток его ведет к задержке роста, потере массы.
Заменимые аминокислоты существенно влияют на потребность в незаменимых аминокислотах. Например, потребность в метионине определяется содержанием цистина в диете. Чем больше в пище цистина, тем меньше расходуется метионина для биологического синтеза цистина.Если в организме скорость синтеза заменимой аминокислоты становится недостаточной, появляется повышенная потребность в ней. Некоторые заменимые аминокислоты становятся незаменимыми, если они не поступают с пищей, так как организм не справляется с быстрым их синтезом. Так, недостаток цистина ведет к торможению роста клеток даже при наличии всех остальных аминокислот в среде. Нарушения синтеза белка возникают при патологической мутации структурных генов. Если в опероне синтеза даже один из структурных генов будет патологическим, то синтезированная и-РНК несет ошибочную информацию о виде и месте включения.
6. Врождённые нарушения аминокислотного обмена у человека. Фенилкетонурия.
У человека известно много различных наследственных нарушений аминокислотного обмена. В основе всех этих нарушений лежит мутация какого-нибудь гена, кодирующего определенный фермент, участвующий в превращениях данной аминокислоты. Под контролем мутантного гена синтезируется дефектный фермент, у которого в том или ином ключевом участке полипептидной цепи может стоять «неправильная» аминокислота. В одних случаях такой наследственно измененный фермент неактивен вообще, а в других проявляет лишь часть присущей ему активности, поскольку характерное для него значение не соответствует норме. Большинство врожденных нарушений аминокислотного обмена у человека сопряжено с накоплением тех или иных промежуточных продуктов этого обмена. При некоторых наследственных заболеваниях такого рода нарушается нормальное развитие нервной ткани, что приводит к умственной отсталости.
фенилаланин (ФА) принадлежит к числу незаменимых аминокислот.
В норме ФА в процессе превращений, которые происходят при помощи ферментов, становится пигментом меланином (определяет окраску кожи и волос) и используется для создания белков в организме. При нарушении активности ферментов и развиваются эти два наследственных заболевания.
Выделяются три формы фенилкетонурии:
фенилкетонурия I имеет аутосомно-рецессивный тип наследования, вызывается мутациями гена;
фенилкетонурия II также наследуется и вызывается, частота заболевания составляет 1 к 100 тыс.;
фенилкетонурия III встречается 1 раз на 30 тыс. новорожденных.
7. Пептиды и их функции.
Пептиды – это олигомеры, составленные из остатков аминокислот. Они имеют невысокую молекулярную массу (содержание остатков аминокислот колеблется от нескольких штук до нескольких сотен). В организме пептиды образуются либо в процессе синтеза из аминокислот, либо при гидролизе (расщеплении) белковых молекул.
На сегодня установлены физиологическое значение и функциональная роль наиболее распространенных групп пептидов, от которых зависят здоровье человека, органолептические и санитарно-гигиенические свойства пищевых продуктов.
Пептиды-буферы. В мышцах животных и человека обнаружены дипептиды, выполняющие буферные функции, то есть поддерживающие постоянный уровень рН.
Пептиды-гормоны. Гормоны – вещества органической природы, вырабатываемые клетками желез, регулируют деятельность отдельных органов, желез и организма в целом: сокращение гладкой мускулатуры организма и секреции молока молочными железами, регуляция деятельности щитовидной железы, активности роста организма, образования пигментов, обуславливающих цвет глаз, кожи, волос.
Нейропептиды. Это две группы пептидов (эндорфины и энкефалины), содержащихся в мозге человека и животных. Они определяют реакции поведения (боязнь, страх), влияют на процессы запоминания, обучения, регулируют сон, снимают боль.
Вазоактивные пептиды синтезируются из белков пищи в результате, они оказывают влияние на тонус сосудов.
Пептидные токсины представляют собой группу токсинов, вырабатываемых мироорганизмами, ядовитыми грибами, пчёлами, змеями, морскими моллюсками и скорпионами. Для пищевой промышленности они нежелательны. Наибольшую опасность представляют токсины микроорганизмов (золотистый стафилококк, бактерии ботулизма, сальмонеллы), в том числе грибков, которые развиваются в сырье, полуфабрикатах и готовых пищевых продуктах.
Пептиды-антибиотики. Представители данной группы пептидов бактериального или грибкового происхождения используется в борьбе с инфекционными заболеваниями, вызываемыми стрептококками, пневмококками, стафилококками и др. микроорганизмами.
Вкусовые пептиды – прежде всего это соединения со сладким или горьким вкусом. Пептиды горького вкуса образуются в молодых ещё незрелых ферментативных сырах. Пептиды со сладким вкусом (аспартам) используются в качестве заменителя сахара.
Протекторные пептиды выполняют защитные функции, прежде всего – антиокислительные.
8. Функции белков. Роль белков в питании человека. Нормы потребления белка.
Белки или протеины – высокомолекулярные азотосодержащие соединения, молекулы которых построены из остатков α – аминокислот.
К наиболее важным функциональным свойствам белков относятся растворимость, водосвязывающая и жиросвязывающая способность, способность стабилизировать дисперсные системы, образовывать гели.
Биологическое значение белков состоит в том, что через белки происходит передача генетической информации из поколения в поколение. Хорошо известна сократительная функция белков – это белки мышечной ткани. Белки играют роль регуляторов и катализаторов,ускоряющих течение биохимических реакций в процессе обмена веществ. Они выполняюттранспортную функцию – переносят по крови гормоны, гемоглобин, железо, липиды и др. Защитная функция – синтезируют антитела. Белки могут быть источником энергии для человека. Но белки никогда не откладываются в запас – избыточное количество поступившего белка расходуется для получения энергии.
Необходимость белка нашему организму объясняется следующим:
Белок необходим для роста и развития.Организм постоянно растет и изменяется. Основным строительным материалом для образования новых клеток является белок.
Белок управляет обменом веществ. При физической нагрузке в мышечной ткани сначала происходит процесс распада веществ – катаболизм или диссимиляция и в это время высвобождается энергия. Затем происходит обратный процесс анаболизм или ассимиляция, при котором энергия запасается. Этими процессами, называемыми «обмен веществ» или метаболизмом, управляют белки.
Белки обладают сильным динамическим воздействием на метаболизм.После еды скорость метаболизма возрастает. Если пища богата углеводами, метаболизм ускоряется на 4%, если белками, то метаболические процессы ускоряются на 30%.
Белки регулируют водный баланс в организме.У здоровых людей белки в сочетании с некоторыми минеральными веществами регулируют содержание воды в разных участках тела. Это происходит потому, что белки гидрофильные, т.е. притягивают воду. Недостаток белков в пищи сказывается на его содержании в крови – она обедняется белками. В результате вода уходит в межклеточное пространство. В этом случае вода не удаляется почками и в результате развивается отек.
Белки усиливают иммунную систему.В крови находятся белковыеантитела. Которые борются с инфекцией, ликвидируя угрозу заболевания.
Белок ограничивается до 20 – 40 г/сут при заболеваниях, связанных с почечной недостаточностью и другими заболеваниями.
В соответствии с критериями Всемирной организации здравоохранения (ВОЗ) норма потребления белка составляет 1г белка на 1 кг массы тела (в среднем, 60-110 г /сутки для взрослых людей).
Учитывая возрастные категории, нормы потребления белка составляют:
■ грудные дети – 3 г/кг;
■ дети 4 – 6 лет – 2 г/кг;
■ дети 10 – 12 лет – 1,5 г/кг;
■ молодежь до 18 – 1 – 1,5 г/кг;
■ взрослые – 0,9 г/кг;
■ беременные женщины и люди старше 60 лет – 1,5 г/кг.
9. Проблема белкового дефицита и пути её решения.
Обеспечение полноценным белковым питанием населения планеты имеет большое значение. Положение дел в этой области весьма неблагополучно. Население Земного шара испытывает острейший дефицит пищевого белка. По данным международной организации (ВОЗ и FAO) в настоящие время каждого жителя планеты приходится около 60г белка в сутки (при норме 70 г). Кроме того, в общем белковом балансе растительные белки составляют 80%, а животные только 20%.Таким образом, имеет место общий количественный дефицит белка при ярко выраженном недостатке животного белка.
Кардинальное решение этой проблемы требует длительных совместных усилий наиболее развитых страх в поисках путей изыскания дополнительных пищевых ресурсов. Основными направлениями решения этой проблемы могут быть следующие:
Повышение продуктивности растениеводства на основе новейших технологий возделывания высокоурожайных сортов сельскохозяйственных культур. (Пример: Индия и Китай смогли обеспечить свои страны достаточным содержанием зерна.)
Развитие животноводства.
Второе направление является более сложным по ряду причин.
Первичный синтез протеиногенных аминокислот и белков происходит в растениях, затем травоядные животные переваривают растительные белки до аминокислот и используют их для синтеза своих специфических белков.
Хищники питаются мясом травоядных, также переваривают их белки до аминокислот и синтезируют из них свои характерные белки.
Таким образом, животные используют только ресурсы, созданные растениями. На каждом этапе этой пищевой цепи имеются большие потери. Причины этих потерь следующие:
Свои потребности в аминокислотах, содержание которых в растительных белках низкое, животные могут удовлетворять только за счет увеличенного потребления растительных белков.
Избыточное количество аминокислот используется не на синтез белка, а на процесс дыхание (энергетические нужды).
В организме животных значительное количество азота превращается в мочевину и удаляется из организма.
Все это приводит к низкой эффективности использования растительных белков животными. На получение одной единицы животного белка, приходится тратить 6 – 8 единиц растительного белка. Исходя из реальных ресурсов, нельзя рассчитывать на значительное увеличение производства животного белка в масштабах планеты.
10. Пищевая и биологическая ценность белков. Незаменимые аминокислоты. Аминокислотный скор. Лимитирующие аминокислоты.
Биологическую ценность белков определяет: Наличие в них незаменимых аминокислот, их соотношение с заменимыми (незаменимых аминокислот 10); Перевариваемость ферментами в пищеварительной системе
Различают биологически ценные и биологически неполноценные белки. Биологически ценные белки содержат все незаменимые аминокислоты в количествах, необходимых для нормального развития организма человека.
Биологическая ценность белков животного происхождения выше, чем растительных белков. Белки, содержащиеся в растениях, не содержат некоторых незаменимых аминокислот или содержат их в недостаточном количестве. Наиболее часто в небольших количествах содержатся лизин, Тренин, триптофан, поэтому растительные белки относятся к неполноценным.
Принято считать, что самым «превосходный» (эталонный),белок содержится в яйцах, а также в материнском молоке. Аминокислотный состав животных белков близок к аминокислотному составу белков человека. Они содержат достаточное количество незаменимых аминокислот и, поэтому, являются полноценными в пищевом отношении белками.
В 1973 году совместным решением Всемирной организации здравоохранения (ВОЗ) и Всемирной продовольственной организации (FAO) введен показатель биологической ценности пищевых белков – аминокислотный скор.
Аминокислотный скор – процентное содержание каждой из аминокислот по отношению к ее содержанию в белке, принятом за стандарт (идеальный белок).
Аминокислотный скор рассчитывают по формуле:
Аминокислотный скор = 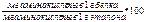
Обычно скор рассчитывают для 3 наиболее дефицитных кислот: лизина, триптофана и суммы серосодержащих аминокислот.
В организме человека синтезируется только часть аминокислот, другие должны доставляться с пищей. Первые из них называются заменимыми, вторые – незаменимыми. Жизнедеятельность человека обеспечивается ежедневным потреблением с пищей сбалансированной смеси, содержащей восемь незаменимых аминокислот и две частично заменимые (аргинин и гистидин). Незаменимые представлены ароматическими (фенилаланин, триптофан), алифатическими (лейцин, валин, изолейцин, лизин), а также содержащими серу (метионин) и гидроксильную группу (треонин).
Отсутствие в пище хотя бы одной незаменимой аминокислоты приводит к неполному усвоению других, что в итоге приводит к тяжёлым клиническим последствиям.
Аминокислоты лимитирующие — это незаменимые А., входящие в состав определенных белков продуктов питания в наименьших количествах в сравнении с их физиологической потребностью и в силу этого ограничивающие полноту использования данного белка в пластических целях; к А. л. относятся лизин (для белков злаковых), метионин (для белков бобовых) и т. д.
11. Проблема обогащения белков лимитирующими аминокислотами.
Одно из разработанных направлений повышения биологической ценности растительных белков связано с их обогащением недостающими аминокислотами. Промышленное производство аминокислот стало крупнотоннажной специализированной отраслью биохимической технологии.
В наибольших количествах производится глутамат натрия, используемый как вкусовая добавка для первых блюд. Его мировое производство достигает 500 тысяч тонн в год. В значительном количестве производится лизин – самая дефицитная аминокислота растений и ряд других аминокислот.
Однако обогащение пищевых продуктов свободными аминокислотами может иметь серьезные негативные последствия по следующим причинам: в результате переваривания белков в пищеварительном тракте образуется аминокислоты, которые поступают в лимфу и кровь и используются как строительный материал при биосинтезе белков. Свободные аминокислоты, используемые для обогащения пищи, минуя пищеварительный процесс сразу поступят в кровеносную систему.
Разрыв во времени поступления в кровяное русло свободных аминокислот и аминокислот, образующихся при переваривании белков пищи составит несколько часов. При этом возникает дисбаланс аминокислот в крови. Это делает невозможным использование поступивших аминокислот для биосинтеза белков в клетках и тканях организма. Они будут подвергаться ферментативным превращениям разного типа. Среди образующихся продуктов могут быть и токсичные соединения.
Часть свободных аминокислот, используемых для обогащения пищевых продуктов, вообще не попадают в кровеносное русло. В кишечнике они станут объектом действия микрофлоры с образованием токсичных продуктов.
Наиболее высокой токсичностью обладают продукты дезаминирования метионина, тирозина и гистидина.
В связи со сказанным полезно вспомнить высказывание академика А.А. Покровского: он призывал быть разумно консервативным в вопросах питания, считая, что всякие резкие изменения в историческом сложившемся типе питания могут привести к нежелательным последствиям.
12. Белково-калорийная недостаточность и её последствия. Квашиоркор.
Некоторые регионы Земли испытывают острую нехватку белка. Белково-калорийная недостаточность наиболее отрицательно проявляется на развитии детского организма, нуждающегося в повышенном поступлении пластического материала для нормального развития.
Белково-энергетическая недостаточность охватывает широкий спектр патологических состояний, наиболее тяжелыми из которых является алиментарный маразм и квашиоркор.
Симптомами алиментарного маразма является низкая для возраста масса тела, исчезновение подкожного жирового слоя, общее истощение мускулатуры. Чаще всего наблюдается у грудных детей и детей младшего возраста.
Квашиоркор – состояние, для которого характерны отеки, низкая масса тела, пигментация кожи. Он поражает, прежде всего, младенцев и детей первых лет жизни. Недостаточное поступление белков с пищей приводит к снижению синтеза клеточных белков и пищеварительных ферментов. В результате организм ребенка утрачивает способность переваривать и усваивать даже то недостаточное поступление белка, которое он получает с пищей.
Квашиоркор сопровождается нарушением физического и умственного развития. Причем последнее носит необратимый характер. Дефекты умственного развития, связанные с недостаточным белковым питанием в возрасте до 3-5 лет, в последующем невозможно выправить даже при самых благоприятных условиях. Отсюда непреложное требование полноценного белкового питания для детского организма.
В странах Древнего Востока, как отмечают источники, существовала своеобразная казнь: приговоренных к смерти кормили только отваренным мясом и они умирали от самоотравления на 28 – 30 день, т.е. гораздо раньше, чем при полном голодании.
13. Нарушение переваривания белков пищи. Пищевые аллергии.
В отличие от жиров и углеводов белки в организме не накапливаются. Белковый обмен протекает с очень высокой скоростью. Поэтому при белковом дефиците очень быстро в белковый обмен включаются строительные белки скелетных мышц, кожи, внутренних органов. Нарушение обмена белка может развиваться при несоответствии поступления белка потребностям организма.
При недостаточном поступлении белка развивается белковое голодание.
Избыточное поступление белка в организм в результате переедания или несбалансированной диеты (пища с высоким содержанием белка) также приводит к нарушениям белкового обмена.
Другой причиной нарушения белкового обмена может стать изменение аминокислотного состава употребляемого белка.
При различных патологических состояниях желудка и кишечника (врожденные, хронические заболевания, сопровождающиеся нарушением всасывания) возможно нарушение расщепления белков и всасывания аминокислот в желудочно-кишечном тракте.
Нарушение содержания белков в плазме крови может быть по типу гиперпротеинемии (увеличение количества белка) или гипопротеинемии (уменьшение).
Пищевая аллергия – это любая аллергическая реакция на нормальную безвредную пищу или пищевые ингредиенты. Какой-либо один вид еды может содержать множество пищевых аллергенов. Как правило, это белки и гораздо реже - жиры и углеводы. При аллергии иммунная система вырабатывает антитела в количестве, превышающем норму, делая тем самым организм настолько реактивным, что он воспринимает безвредный белок так, как если бы это был инфекционный агент. Если иммунная система не вовлечена в процесс, то это не пищевая аллергия, а непереносимость пищи.
Истинная пищевая аллергия встречается редко (менее чем у двух процентов населения). Чаще всего причиной ее является наследственность. У детей аллергия обычно проявляется в первые годы жизни (часто к яичным белкам), а затем они «перерастают» ее. Среди взрослых, полагающих, что у них есть пищевая аллергия, примерно 80% на самом деле испытывают состояние, которое эксперты окрестили «пищевой псевдоаллергией». Хотя симптомы, которые наблюдаются у них, подобны тем, что бывают при истинной пищевой аллергии, причина может крыться в простой непереносимости пищи. Более того, у некоторых людей могут развиться психосоматические реакции на еду потому, что они считают, что она является для них аллергеном.
14. Новые формы белковой пищи. Основные задачи технологии производства пищевого белка.
Основным направлением научно-технического прогресса в области производства продовольствие является интенсификация процессов приготовления пищи с одновременным приданием ей комплекса свойств, отражающих требованиям науки о здоровом питании. Новые пищевые производства в качестве приоритетных включают технологии получения белковых продуктов.
Объективными причинами создания принципиально новых технологий получения белковых компонентов пищи следующие:
- рост численности населения;
- осознание того, что ресурсы планеты не безграничны;
необходимость выпуска пищевых продуктов с составом, соответствующим современному образу жизни.
К потенциальным сырьевым источникам относят: зернобобовые (соя, горох, чечевица и др.);
хлебные и крупяные культуры (пшеницы, рожь, овес и др.); масличные (подсолнечник, лен, рапс и др.); вегетативная масса растений (люцерна, клевер и др.); продукты переработки фруктов и ягод (косточки абрикосов, сливы и т.п.); кедровые и другие орехи.
Традиционными для производства белковых продуктов является соя и пшеница.
Характерной особенностью новой пищевой технологии является применение комплексной переработки продовольственного сырья, что позволяет использовать огромные потенциальные ресурсы белка и других нутриентов.
Новые продукты питания, получаемые на основе грубых белковых фракций продовольственного сырья, принято в научной литературе называть новыми формами пищи, а также текстурированными, структурированными и искусственными пищевыми продуктами.
Основными задачами технологии производства пищевого белка является:
- Извлечение его из сырья с максимальным выходом при минимальных затратах и потерях других ценных компонентов;
- Минимальные изменения функциональных свойств белка или направленное изменение в желаемую сторону;
- Сохранение биологической, пищевой ценности белка;
15. Запасные белки семян растений и их функции. Клейковина пшеницы. Факторы, определяющие качество клейковины.
Основную массу белков зерна составляют простые белки, называемые запасными белками. Они накапливаются в созревающем зерне и служат для питания зародыша на начальных этапах прорастания. Запасные белки злаков и бобовых культур локализованы в эндосперме, а в семенах масленых культур – в зародыше. В последнее время установлено, что эти белки обладают ферментативной активностью.
Запасные белки зерна и семян разных культур характеризуется определенным фракционным составом. Любое извлечение белка растворителем нарушает природную структуру белковой молекулы, т.к. разрушает или изменяет нековалентные связи, т.е. извлечение белка из растительного материала всегда сопровождается начальной стадией денатурации.
При извлечении же белков раствором щелочи происходит разрыв даже дисульфидных связей (-S-S-).
Клейковина – была открыта в 1745 г итальянским ученным Беккари в пшеничной муке. Клейковинные белки содержатся также в зерне некоторых сортов ячменя, пырея и др. По данным Казакова Е.Д., некоторые сорта пырея содержат более 65% сырой клейковины. Содержание клейковины в зерне и муке пшеницы является важным показателем качества.
Сырая клейковина содержит 2/3 (66%) воды и 1/3 сухого вещества, которое в основном состоит из белков. От количества и реологических свойств клейковины зависит способность пшеничной муки давать при выпечке пышный хлеб с упругим эластичным и пористым мякишем.
Клейковина представляет собой сложный белковый комплекс, состоящий из 2-х фракций - глиадиновой и глютениновой в соотношении 1:1 (белки составляют 80-85%, углеводы 10-15%, липиды 2-8%)
Клейковина разного качества имеет одинаковый аминокислотный состав и состоит из одних и тех же белковых компонентов. Но прочность их взаимного соединения разная. В крепкой клейковине «плотность упаковки» белковых элементов выше, чем в слабой.
В формировании структуры клейковины и ее свойств важную роль играют дисульфидные (–S-S-) и водородные связи. Прочность и одновременно подвижность структуры молекулы клейковины создают специфические свойства – упругость, эластичность, растяжимость и др. Это объясняется наличием большого количества нековалентных связей, которые легко разрываются и вновь возникают при различных воздействиях на белок.
Качество клейковины тесно связанно с количеством дисульфидных связей, что оценивается соотношением число –S-S- связей к числу SH- групп.
В зависимости от реологических свойств клейковины сорта пшеницы подразделяются на твердые и мягкие.
У твердой пшеницы клейковина крепкая, при растяжении короткорвущаяся. Тесто получается прочное, с высокой упругостью, малорастяжимое. Такими свойствами должно обладать тесто для изготовления макаронных изделий, манной крупы.
У мягкой пшеницы клейковина сочетает упругость с эластичностью и растяжимостью. Тесто имеет хорошую газоудерживающую способность и при выпечке дает хлеб пористой структуры. Такие свойства необходимы для производства хлебобулочных изделий.
16. Глиадин и глютенин пшеницы, их особенности. Значение электрофоретического спектра глиадина.
17. Белки семян бобовых культур, их питательная ценность, особенности белкового комплекса.
Семена бобовых отличаются высоким содержанием белка (20-40%) и его хорошим аминокислотным составом. Лимитирующими считают сумму серосодержащих аминокислот (метионин + цистин), которые в избыточном количестве содержатся в белках злаковых. Поэтому в пищевом отношении белки бобовых хорошо дополняют белки злаков. До 80% белков бобовых приходится на фракции альбуминов и глобулинов.
Отличительной особенностью белкового комплекса бобовых является высокое содержание ингибиторов протеаз и особых белков гликопротеиновой природы – лектинов (от латинского выбирать).
Самой ценной культурой семейства бобовых является соя, в семенах которой содержится до 40% белка и 20% жира. Однако питательная ценность белков сои, не прошедшей термическую обработку, очень низкая. Это связанно с высоким содержанием в бобах сои ингибиторов протеаз разного типа. Одни из них подавляют активность пищеварительных ферментов, например, ингибитор Кунитца (ингибитор трипсина и химотрипсина). Другие ингибируют собственные протеазы семян сои.
Лектины свое название получили по специфической способности вызывать избирательную агглютинацию эритроцитов крови. Они составляют от 2 до 10% общего белка.
Агглютинация (от латинского «приклеивание») – агрегация, склеивание, частиц, клеток, спор. Одна из функций лектинов – узнавание клеток.
Агглютинация происходит благодаря взаимодействию лектинов с углеводными компонентами клеточных пов
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|