
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Физическая химия
Физическая химия
Ф1. При разработке заданий с использованием энергетических эффектов реакции должное внимание следует уделять использованию закона Гесса и следствий из него.
При конденсации 9 г воды выделяется 22 кДж теплоты. Рассчитайте количество теплоты, затрачиваемое на испарение 15 г воды при стандартном давлении. (Ответ: 36,67 кДж)
Ф2. Известны тепловые эффекты следующих реакций:
C2H2(г) = 2С(графит) + H2(г); Q = 226,7 кДж/моль (1);
3C2H2(г) = C6H6(ж); Q = 631,1 кДж/моль (2);
C6H6(ж) = С6H6(г); Q = –33,9 кДж/моль (3).
Рассчитайте стандартную теплоту образования газообразного бензола из простых веществ. (Ответ: Q= -82,9 кдж/моль).
Ф3. Рассчитайте энергию связи С–H в CH4, используя следующие термохимические уравнения:
C(графит) + 2H2(г) = CH4(г) + 74,9 кДж (1)
C(ат.) = C(графит) + 715,0 кДж (2)
2H(ат.) = H2(г) + 433,5 кДж (3)
Для решения этих задач требуется владеть понятиями стандартная теплота образования вещества, энергия связи, теплота фазового перехода (кипения, конденсации, возгонки и т.д.). (Ответ: ЕС-Н = 414,225 кДж).
Ф4. Теплоты образования органических веществ можно достаточно точно оценивать при помощи следующего метода: учитывается вклад каждой функциональной группы.
Рассчитайте теплоту образования метилпропана, если известны вклады СН (9.2 кДж/моль), СН3 (48.5 кДж/моль). (Ответ: Qобр.= 154,7 кДж/моль).
Ф5. Для задач на химическое равновесие следует активно использовать знание принципа Ле Шателье, а также понятия «равновесие» и «константа равновесия».
Напишите выражение для константы электролитической диссоциации сернистой кислоты по второй ступени. Как сместится равновесие в растворе сернистой кислоты при добавлении к нему небольшого количества сульфита натрия? Ответ обоснуйте.
Ф6. К нитрату железа (III) добавили раствор роданида аммония до образования красно-оранжевого раствора. Полученный раствор разделили на четыре пробирки. Первую оставили в качестве «свидетеля». Во вторую добавили нитрат железа, в третью – роданид аммония, а в четвертую - избыток твердого хлорида натрия. Опишите наблюдаемые явления и дайте им обоснование, используя принцип Ле Шателье.
Ответ: во второй и третьей пробирках окраска усилится из-за смещения равновесия в сторону образования роданидного комплекса железа, а в четвертой – интенсивность окраски уменьшится из-за образования хлоридного комплекса железа.
Ф7. Скорость реакции. Правило Вант-Гоффа. Во сколько раз изменится скорость химической реакции при уменьшении температуры на 30оС, если температурный коэффициент равен 3? (Ответ: уменьшится в 27 раз).
Ф8. Скорость реакции. Правило Вант-Гоффа. Определите время, за которое прореагирует половина исходных веществ реакции при 20оС, если период полураспада при 40оС равен 8 минут. Температурный коэффициент принять равным 2. (Ответ: τ1/2'= 32 мин).
Ф9. В силу того, что расчет кинетических параметров требует довольно сложный математический аппарат, задачи по кинетике должны быть демократичными для большинства учащихся. При этом работа с экспонентами должна прочно входить в арсенал участников олимпиады по химии.
Энергия активации некоторой реакции в отсутствие катализатора равна 80 кДж/моль, а в присутствии катализатора энергия активации уменьшается до значения 53 кДж/моль. Во сколько раз и каким образом изменится скорость реакции в присутствии катализатора, если реакция протекает при 20оС?
Задача на использование уравнения Аррениуса. (Ответ: скорость реакции увеличится ν2/ν1=5,4·104 раз).
Ф10. Определить энергию активации Еа реакции, для которой при повышении температуры от 22 до 42 °C константа скорости возрастает в 7 раз. (Ответ: Еа=75170 Дж/моль).
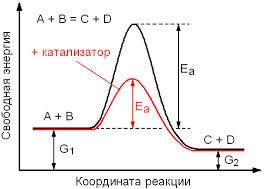
Ф11. Изобразите энергетическую диаграмму экзо- и эндотермической реакций. Поясните основные ее компоненты. Благодаря чему катализатор увеличивает скорость химической реакции? Поясните это графически.
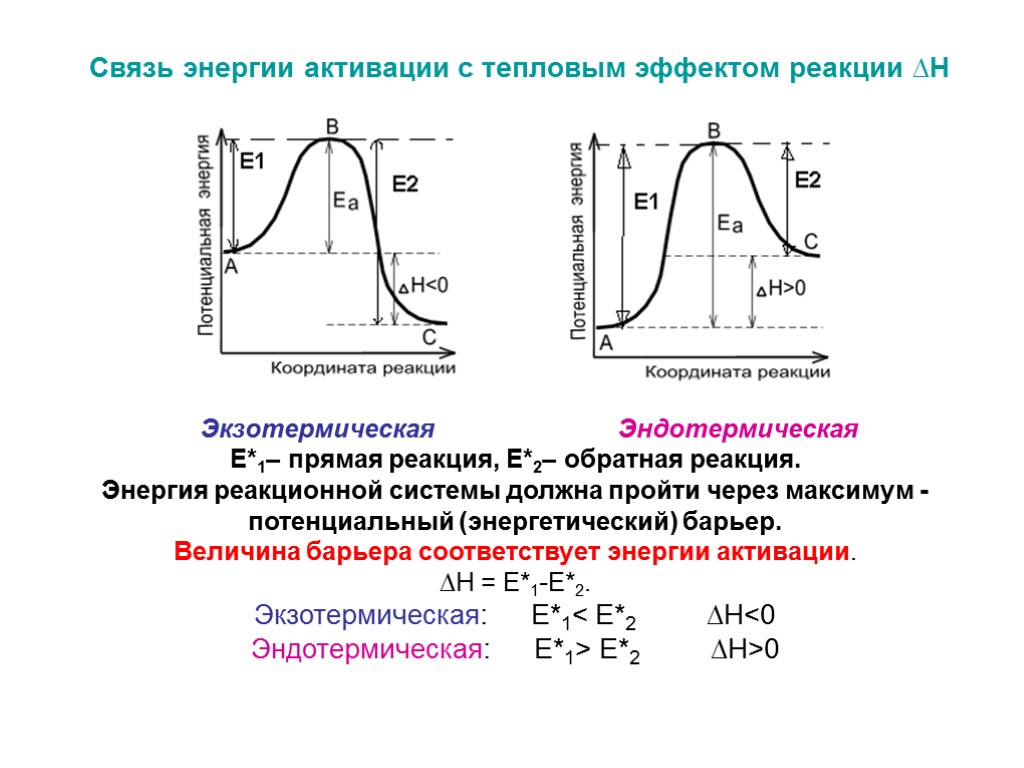
Катализатор увеличивает скорость химической реакции за счет снижения Еа
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|