
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
ПРАКТИЧЕСКАЯ РАБОТА №6. Тема: «Определение порядка констант скорости, энергии активации реакций. Катализ». ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
ПРАКТИЧЕСКАЯ РАБОТА №6
Тема: «Определение порядка констант скорости, энергии активации реакций. Катализ»
Цель работы:расчет констант скорости реакции, энергии активации и характеристик процесс идущих в присутствии катализаторов.
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
Скорость химической реакции измеряется количеством вещества, вступающего в реакцию или образующегося в результате реакции в единицу времени в единице объема системы (для гомогенной реакции) или на единице площади поверхности раздела фаз (для гетерогенной реакции).
Константа скорости реакции I порядка:
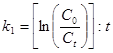 , мин-1, сек-1
, мин-1, сек-1
Для реакции II порядка константа скорости реакции: 
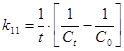 , мин-1, сек-1
, мин-1, сек-1
Константу скорости реакции для реакции I порядка можно определить по периоду полураспада:
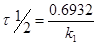
Энергия активации 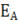 – некоторая избыточная энергия, которой должны обладать молекулы для того, чтобы их столкновение было эффективным, т. е. привело бы к образованию нового вещества.
– некоторая избыточная энергия, которой должны обладать молекулы для того, чтобы их столкновение было эффективным, т. е. привело бы к образованию нового вещества.
Расчет энергии активации:
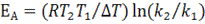 , [Дж]
, [Дж]
Катализатор – вещество, которое увеличивает скорость реакции, само оставаясь по окончании реакции химически неизменным. Наличие в системе катализатора может изменять константу скорости химического процесса и его скорость при заданных концентрациях реагентов.
Катализатор характеризуется:
Активность катализатора – относительное ускорение реакции под влиянием катализатора (Вк)
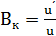
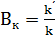
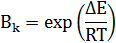
Производительность катализатора– характеристика ускоряющего действия твердого катализатора на производстве (Пк)
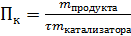 , [ч-1]
, [ч-1]
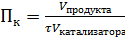 , [ч-1]
, [ч-1]
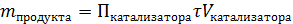 , [кг/ч]
, [кг/ч]
Селективность катализатора – характеристика направленности действия катализатора (Sк)
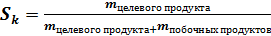 100 %
100 %
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|