
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
ПРАКТИЧЕСКАЯ РАБОТА №5. Тема: «Расчеты константы равновесия реакции по термодинамическим характеристикам». ТЕОРЕТИЧЕСКАЯ ЧАСТЬ. ПРАКТИЧЕСКАЯ ЧАСТЬ. ВАРИАНТ №1
ПРАКТИЧЕСКАЯ РАБОТА №5
Тема: «Расчеты константы равновесия реакции по термодинамическим характеристикам»
Цель работы: определение констант равновесия и смещения химического равновесия.
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
Таблица 1 - Смещение равновесия при различных параметрах
| Параметр и его изменение | Направление смещения равновесия | |
| Концентрация | С исх > С конечн | С исх < С конечн |
| ↑ | → | ← |
| ↓ | ← | → |
| Давление | V исх > V конечн | V исх < V конечн |
| ↑ | → | ← |
| ↓ | ← | → |
| Температура | Эндо (–Q) | Экзо (+Q) |
| ↑ | → | ← |
| ↓ | ← | → |
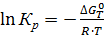 (1)
(1)
–ΔGоТ – энергия Гиббса (значения взять из практической работы №4),
R – универсальная газовая постоянная (8,314 Дж/моль ×К),
Т – температура в К (взять из практической работы №4)
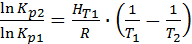 (2)
(2)
ПРАКТИЧЕСКАЯ ЧАСТЬ
ВАРИАНТ №1
1. Куда сместится равновесие реакции:N2 + О2 ↔ NO – Q, при уменьшении температуры, увеличении давления, увеличение концентрации оксида азота
2. Для каких из указанных реакций повышение давления приведет к смещению равновесия в том же направлении, что и понижение температуры?
а) N2 + O2 NO – Q;
б) CO2 + C CO – Q;
в) CO + O2 CO2 + Q;
г) CO + H2O (г.) CO2 + H2 + Q
3. Определить константу равновесия реакции, исходные данные взять из практической работы №4
4. Вычислить константу равновесия и определить исходные концентрации азота и водорода для реакции синтеза аммиака: N2 + 3H2 =2NH3. Равновесные концентрации веществ соответственно равны - [N2] = 1,5; [Н2] = 1,9; [NH3] = 4,6.
5. Рассчитать константу равновесия реакции при Т = 1100К, если при Т = 800К эта величина равна 0,24 и величина Н°800 = – 88,51 КДж/моль
ВАРИАНТ №2
1. Как повлияет уменьшение давления и увеличение температуры на равновесие в реакциях:
А) N2O4 ↔ NO2
Б) NO + O2 ↔ NO2
В) Fe2O3к + СOг ↔ Fe3O4к + СO2г
2. Для обратимой химической реакции CO(г) + H2O(г) ↔ CH3OH (г) + Q
Подберите такие условия (температура, давление, концентрации исходных веществ и продуктов реакции), которые сместят её положение равновесия вправо.
3. Определить константу равновесия реакции, исходные данные взять из практической работы №4
4. Вычислить константу равновесия и определить исходные концентрации азота и водорода для реакции синтеза аммиака: N2 + 3H2 =2NH3. Равновесные концентрации веществ соответственно равны - [N2] = 1,5; [Н2] = 1,9; [NH3] = 5,6.
5. Рассчитать константу равновесия реакции при Т = 1200К, если при Т = 900К эта величина равна 0,25 и величина Н°900 = – 87,5 КДж/моль
ВАРИАНТ №3
1. Какое влияние на равновесное состояние системы CO2+C(тв) ↔ CO – Q окажут: а) увеличение давления; б) повышение температуры; в) введение катализатора, г) увеличение концентрации исходных веществ
2. Куда сместится равновесие реакции:N2 + О2 ↔ NO – Q, при увеличении температуры, уменьшении давления, увеличение концентрации оксида азота
3. Определить константу равновесия реакции, исходные данные взять из практической работы №4
4. Вычислить константу равновесия и определить исходные концентрации азота и водорода для реакции синтеза аммиака: N2 + 3H2 =2NH3. Равновесные концентрации веществ соответственно равны - [N2] = 1,5; [Н2] = 1,9; [NH3] = 4,6.
5. Рассчитать константу равновесия реакции при Т = 1255К, если при Т = 950К эта величина равна 0,26 и величина Н°950 = – 86,44 КДж/моль
ВАРИАНТ №4
1.Какие факторы способствуют смещению равновесия в эндотермической реакции восстановления оксида железа(III) с помощью водорода в сторону прямой реакции?
Fe2О3тв + Н2 г → Feтв + Н2О г – Q
2.Эндотермическая реакция разложения пентахлорида фосфора протекает по уравнению:
PCl5(г) → РСl3(г) + Сl2(г) - 92,59 кДж.
Как надо изменить: а) температуру; б) давление; в) концентрацию, чтобы сместить равновесие в сторону прямой реакции – разложения PCl5?
3. Определить константу равновесия реакции, исходные данные взять из практической работы №4
4. Вычислить константу равновесия и определить исходные концентрации азота и водорода для реакции синтеза аммиака: N2 + 3H2 =2NH3. Равновесные концентрации веществ соответственно равны - [N2] = 3,5; [Н2] = 1,7; [NH3] = 6,6.
5. Рассчитать константу равновесия реакции при Т = 1111К, если при Т = 811К эта величина равна 0,24 и величина Н°950 = – 87,44 КДж/моль
ВАРИАНТ №5
1. Реакция протекает по уравнению: SO2г + О2г ↔ SO3ж +284,2 кДж. Изменением, каких параметров можно добиться смещения равновесия в сторону образования оксида серы VI)?
2. Как повлияет увеличение давления и уменьшение температуры на химическое равновесие в обратимой системе: Fe2О3к + H2г ↔ Feк + Н2О
3. Определить константу равновесия реакции, исходные данные взять из практической работы №4 согласно своего номера варианта
4. Вычислить константу равновесия и определить исходные концентрации азота и водорода для реакции синтеза аммиака: N2 + 3H2 =2NH3. Равновесные концентрации веществ соответственно равны - [N2] = 4,5; [Н2] = 1,8; [NH3] = 5,6.
5. Рассчитать константу равновесия реакции при Т = 1100К, если при Т = 850К эта величина равна 0,26 и величина Н°850 = – 88,52 КДж/моль
ВАРИАНТ №6
1. Как надо изменить температуру и давление (увеличить, или уменьшить), чтобы равновесие в реакции разложения карбоната кальция СаСО3к ↔ СаОк + СО2г - 178 кДж, сместить в сторону продуктов
2. Как повлияет увеличение давления и температуры на равновесие в системах:
а) SO2г + CI2г ↔ SO2CI2г б) Н2г + Вг2г ↔ НВгг
3. Определить константу равновесия реакции, исходные данные взять из практической работы №4.
4. Вычислить константу равновесия и определить исходные концентрации азота и водорода для реакции синтеза аммиака: N2 + 3H2 =2NH3. Равновесные концентрации веществ соответственно равны - [N2] = 1,7; [Н2] = 2,0; [NH3] = 3,6.
5 Рассчитать константу равновесия реакции при Т = 1200К, если при Т = 900К эта величина равна 0,25 и величина Н°900 = – 90,15 КДж/моль
ВАРИАНТ №7
1. Какие факторы способствуют смещению равновесия в эндотермической реакции восстановления оксида железа(III) с помощью водорода в сторону прямой реакции? Fe2О3тв + Н2 г →Feтв + Н2О г – Q
2. Какое влияние на равновесное состояние системы NH3(г) + O2(г)↔ N2(г )+ H2O(г) + Q окажут:
а) увеличение давления;
б) повышение температуры;
в) введение катализатора?
г) увеличение концентрации исходных веществ
3. Определить константу равновесия реакции, исходные данные взять из практической работы №4.
4. Вычислить константу равновесия и определить исходные концентрации азота и водорода для реакции синтеза аммиака: N2 + 3H2 =2NH3. Равновесные концентрации веществ соответственно равны - [N2] = 1,4; [Н2] = 2,1; [NH3] = 3,7
5. Рассчитать константу равновесия реакции при Т = 1200К, если при Т = 820К эта величина равна 0,23 и величина Н°820 = – 85,53 КДж/моль
ВАРИАНТ №8
1. Какие факторы способствуют смещению равновесия в экзотермической реакции образования сероводорода из простых веществ в сторону образования продукта реакции?
Н2 г + S тв Н2S г + Q
2. Какое влияние на равновесное состояние системы CO2+C(тв) ↔ CO – Q окажут:
а) увеличение давления;
б) повышение температуры;
в) введение катализатора?
г) увеличение концентрации исходных веществ
3. Определить константу равновесия реакции, исходные данные взять из практической работы №4.
4. Вычислить константу равновесия и определить исходные концентрации азота и водорода для реакции синтеза аммиака: N2 + 3H2 =2NH3. Равновесные концентрации веществ соответственно равны - [N2] = 1,3; [Н2] = 2,0; [NH3] = 3,9
5. Рассчитать константу равновесия реакции при Т = 1100К, если при Т = 950К эта величина равна 0,26 и величина Н°950 = – 91,52 КДж/моль
ВАРИАНТ №9
1. Какое влияние на равновесное состояние системы CS2(г) + H2(г) ↔ CH4(г) + H2S(г) + Q окажут:
а) увеличение давления;
б) повышение температуры;
в) введение катализатора?
г) увеличение концентрации продуктов реакции
2. Для обратимой химической реакции CO(г) + H2O(г) ↔ CH3OH (г) + Q
Подберите такие условия (температура, давление, концентрации исходных веществ и продуктов реакции), которые сместят её положение равновесия вправо.
3. Определить константу равновесия реакции, исходные данные взять из практической работы №4.
4. Вычислить константу равновесия и определить исходные концентрации азота и водорода для реакции синтеза аммиака: N2 + 3H2 =2NH3. Равновесные концентрации веществ соответственно равны - [N2] = 1,6; [Н2] = 2,0; [NH3] = 3,8
5. Рассчитать константу равновесия реакции при Т = 1230К, если при Т = 1000К эта величина равна 0,29 и величина Н°1000 = – 92,52 КДж/моль
ВАРИАНТ №10
1. Как повлияет увеличение давления и уменьшения температуры на химическое равновесие в обратимой системе:
Fe2О3к + H2г ↔ Feк + Н2Ог
2. Как надо изменить температуру, концентрацию SiO2 и давление (увеличить или уменьшить), чтобы равновесие в реакции сместить в сторону продуктов
SiO2тв + Cтв → Siтв + CO + Q
3. Определить константу равновесия реакции, исходные данные взять из практической работы №4.
4. Вычислить константу равновесия и определить исходные концентрации азота и водорода для реакции синтеза аммиака: N2 + 3H2 =2NH3. Равновесные концентрации веществ соответственно равны - [N2] = 4,0; [Н2] = 3,0; [NH3] = 8,0
5. Рассчитать константу равновесия реакции при Т = 1231К, если при Т = 1100К эта величина равна 0,25 и величина Н°1100 = – 86,44 КДж/моль
ВАРИАНТ №11
1.Как повлияет увеличение давления и уменьшение температуры на химическое равновесие в обратимой системе:
H2 + O2↔ H2O
2. Какое влияние на равновесное состояние системы CS2(г) + H2(г) ↔ CH4(г) + H2S(г) - Q окажут:
а) увеличение давления;
б) повышение температуры;
в) введение катализатора?
г) увеличение концентрации продуктов реакции
3. Определить константу равновесия реакции, исходные данные взять из практической работы №4.
4. Вычислить константу равновесия и определить исходные концентрации азота и водорода для реакции синтеза аммиака: N2 + 3H2 =2NH3. Равновесные концентрации веществ соответственно равны - [N2] = 3,9; [Н2] = 2,9; [NH3] = 7,9
5. Рассчитать константу равновесия реакции при Т = 1050К, если при Т = 800К эта величина равна 0,26 и величина Н°800 = – 89,11 КДж/моль
ВАРИАНТ №12
1. Как повлияет увеличение давления и уменьшение температуры на химическое равновесие в обратимой системе:
HI ↔ H2 + I2 – Q
2. Для каких из указанных реакций повышение давления приведет к смещению равновесия в том же направлении, что и понижение температуры?
а) N2 + O2 NO – Q;
б) CO2 + C CO + Q;
в) CO + O2 CO2 + Q;
г) CO + H2O (г.) CO2 + H2 + Q
3. Определить константу равновесия реакции, исходные данные взять из практической работы №4.
4. Вычислить константу равновесия и определить исходные концентрации азота и водорода для реакции синтеза аммиака: N2 + 3H2 =2NH3. Равновесные концентрации веществ соответственно равны - [N2] = 3,8; [Н2] = 2,8; [NH3] = 7,7
5. Рассчитать константу равновесия реакции при Т = 1150К, если при Т = 900К эта величина равна 0,25 и величина Н°900 = – 89,23 КДж/моль
ВАРИАНТ №13
1. Какое влияние на равновесное состояние системы CS2(г) + H2(г) ↔ CH4(г) + H2S(г) + Q окажут:
а) уменьшение давления;
б) уменьшение температуры;
в) введение катализатора?
г) уменьшение концентрации продуктов реакции
2. Для обратимой химической реакции CO(г) + H2O(г) ↔ CH3OH (г) + Q
Подберите такие условия (температура, давление, концентрации исходных веществ и продуктов реакции), которые сместят её положение равновесия влево.
3. Определить константу равновесия реакции, исходные данные взять из практической работы №4.
4. Вычислить константу равновесия и определить исходные концентрации азота и водорода для реакции синтеза аммиака: N2 + 3H2 =2NH3. Равновесные концентрации веществ соответственно равны - [N2] = 3,7; [Н2] = 2,6; [NH3] = 7,6
5. Рассчитать константу равновесия реакции при Т = 1147К, если при Т = 940К эта величина равна 0,24 и величина Н°940 = – 90,22 КДж/моль
ВАРИАНТ №14
1. Какие факторы способствуют смещению равновесия в эндотермической реакции восстановления оксида железа(III) с помощью водорода в сторону прямой реакции? Fe2О3тв + Н2 г →Feтв + Н2О г – Q
2. Какое влияние на равновесное состояние системы NH3(г) + O2(г)↔ N2(г )+ H2O(г) + Q окажут:
а) уменьшение давления;
б) уменьшение температуры;
в) введение катализатора?
г) уменьшение концентрации исходных веществ
3. Определить константу равновесия реакции, исходные данные взять из практической работы №4.
4. Вычислить константу равновесия и определить исходные концентрации азота и водорода для реакции синтеза аммиака: N2 + 3H2 =2NH3. Равновесные концентрации веществ соответственно равны - [N2] = 1,4; [Н2] = 2,0; [NH3] = 3,6
5. Рассчитать константу равновесия реакции при Т = 1150К, если при Т = 1000К эта величина равна 0,29 и величина Н°1000 = –89,24 КДж/моль
ВАРИАНТ №15
1. Реакция протекает по уравнению: SO2г + О2г ↔ SO3ж +284,2 кДж. Изменением, каких параметров можно добиться смещения равновесия в сторону исходных веществ?
2. Как повлияет уменьшения давления и увеличение температуры на химическое равновесие в обратимой системе:
Fe2О3к + H2г ↔ Feк + Н2О
3. Определить константу равновесия реакции, исходные данные взять из практической работы №4.
4. Вычислить константу равновесия и определить исходные концентрации азота и водорода для реакции синтеза аммиака: N2 + 3H2 =2NH3. Равновесные концентрации веществ соответственно равны - [N2] = 1,3; [Н2] = 2,1; [NH3] = 4,6
5. Рассчитать константу равновесия реакции при Т = 1120К, если при Т = 1000К эта величина равна 0,24 и величина Н°1000 = – 89,23 КДж/моль
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|