
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
ПРАКТИЧЕСКАЯ РАБОТА №4. Тема: «Расчеты термодинамических потенциалов и определение направления самопроизвольного течения процесса». ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
ПРАКТИЧЕСКАЯ РАБОТА №4
Тема: «Расчеты термодинамических потенциалов и определение направления самопроизвольного течения процесса»
Цель работы: определение самопроизвольного течения процесса.
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
Закон Гесса:Тепловой эффект химической реакции при постоянном давлении и объеме не зависит от пути реакции (т.е. от промежуточных стадий), а определяется начальным и конечным состоянием системы (т.е. состоянием исходных веществ и продуктов реакции (газ, жид., тв.).
ΔН0298 – стандартная энтальпия реакции, тепловой эффект реакции. (кДж/моль).
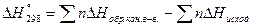 [КДж], n – количество вещества
[КДж], n – количество вещества
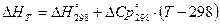 [КДж]
[КДж]
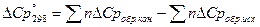 [Дж/К]
[Дж/К]
При протекании процессов происходит изменение функции состояния системы, называемой энтропией или количественной мерой беспорядка в системе.
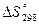 - энтропия,
- энтропия,
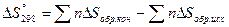 [Дж/К]
[Дж/К]
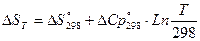 [Дж/К]
[Дж/К]
Так как, металлургические процессы чаще всего протекают при постоянном давлении, то их возможность определяют по изобарно-изотермическому потенциалу – энергии Гибба, обозначается – G.
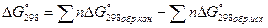 [КДж]
[КДж]
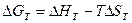 [КДж]
[КДж]
Таблица. Самопроизвольность протекания реакций
| ∆H | ∆S | ∆G | Свойство |
| − | + | ∆G<0 | Реакция протекает самопроизвольно при любых температурах |
| + | − | ∆G>0 | Реакция не протекает самопроизвольно ни при каких температурах; обратная реакция самопроизвольна |
| − | − | ∆G>0 ∆G<0 | (если >0) реакция протекает самопроизвольно, (если <0) реакция протекает самопроизвольно |
| + | + | ∆G>0 ∆G<0 | Реакция в любом случае самопроизвольна |
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|