
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Первый закон термодинамики»
«Первый закон термодинамики»
В большей части задач используется не общая форма первого закона термодинамики, а его различные частные формулировки, применимые к определённым процессам. Задачи на теплообмен в изолированной системе решаются с помощью уравнения теплового баланса.
Первый закон термодинамики гласит, (4 разные формулировки) что :
· Энергия не может быть создана или уничтожена (закон сохранения энергии), она лишь переходит из одного вида в другой в различных физических процессах. Отсюда следует, что внутренняя энергия изолированной системы остается неизменной.
· Количество теплоты, полученное системой, идет на изменение ее внутренней энергии и совершение работы против внешних сил.
· Изменение внутренней энергии системы при переходе ее из одного состояния в другое равно сумме работы внешних сил и количества теплоты, переданной системе и не зависит от способа, которым осуществляется этот переход.
· Изменение внутренней энергии неизолированной термодинамической системы равно разности между количеством теплоты, переданной системе, и работой, совершенной системой над внешними силами.
Первый закон термодинами гласит, что энергия не может быть создана или уничтожена. Таким образом, энергия системы (замкнутой) - постоянна. Тем не менее, энергия может быть передана от одного элемента системы другому. Рассмотрим замкнутую систему, изолированную от остальных.
Передача энергии между различными подсистемами в ней может быть описана как :
E1 = E2
где
E1 = начальная энергия
E2 = конечная энергия
Внутрення энергия включает :
Кинетическую энергию движения атомов
Потенциальную энергию хранящуюся в химических связях
Гравитационную энергию системы
Первый закон является основой для термодинамической науки и инженерного анализа.
Базируется на возможных типах обмена (энергии), ниже приведены 3 типа систем:
пред - изолированные системы (isolated systems): отсутствует обмен элементами системы или энергией
закрытые системы (closed systems): отсутствует обмен элементами системы, но присутствует некоторый обмен энергией
открытые системы (open systems): возможен обмен как элементами системы, так и энергией
Первый закон термодинамики помогает использовать ключевые концепции внутренней энергии (internal energy), тепла (heat), и работы системы (system work). которые широко используются в описании тепловых систем (heat engines).
Внутренняя энергия ( Internal Energy) - Внутренняя энергия определяется как энергия случайных, находящихся в неупорядченном движении молекул. Энергия молекул находится в диапазоне от высокой, необходимой для движения, до заметной лишь с помощью микроскопа энергии на молекулярном или атомном уровне. Например, у стакана с водой комнатной температы, стоящего на столе нет, на первый взгляд, никакой энергии: ни кинетической, ни потенциальной относительно стола. Но, с помощью микроскопа становится заметна "бурлящая" масса быстро двигающихся молекул. Если выплеснуть воду из стакана, эта микроскопическая энергия не обязательно заметно изменится, когда мы усредним добавленную кинетическую энергию на все молекулы воды.
Тепло - Тепло может быть определено, как энергия, передаваемая от объекта с более высокой температурой к объекту с менее высокой температурой. Сам по себе объект не обладает "теплом"; соответствующий термин для микроскопической энергии объекта - внутренняя энергия. Внутренняя энергия может увеличиваться путем переноса энергии к объекту от объекта, имеющего температуру выше - этот процесс называется нагревом.
Работа - Когда работа совершается термодинамической системой (чаще всего это газ, который совершает работу), то работа совершенная газом при постоянном давлении определяется как : W = p dV, где W - работа, p - давление, а dV -изменение объема.
В случаях когда давление не является постоянным, работа может быть представлена интегральным образом, как площадь поверхности под кривой в координатах давление, объем, которые представляют происходящий процесс.
Изменение внутренней энергии системы равно теплу (добавленному системе) минус работа, совершенная системой
dE = Q - W
где
dE = изменение внутренней энергии
Q = добавленное тепло
W =работа системы


При решении задач надо чётко выделять начальное и конечное состояния системы, а также характеризующие её параметры.
Задача 1. Во время расширения газа, вызванного его нагреванием, в цилиндре с площадью поперечного сечения S = 200 см2 газу было передано количество теплоты Q = 1,5 • 105 Дж, причём давление газа оставалось постоянным и равным р = 2 • 107 Па. На сколько изменилась внутренняя энергия газа, если поршень передвинулся на расстояние Δh = 30 см?
Р е ш е н и е. Согласно первому закону термодинамики в форме (13.12) Q = ΔU + А', где А' = pSΔh — работа, совершённая газом. Отсюда ΔU = Q - pSΔh = 30 кДж.
 Задача 2. Газ расширяется от объёма V1 до объёма V2 один раз изотермически, другой изобарно и третий адиабатно. При каком процессе газ совершает большую работу и при каком газу передаётся большее количество теплоты?
Задача 2. Газ расширяется от объёма V1 до объёма V2 один раз изотермически, другой изобарно и третий адиабатно. При каком процессе газ совершает большую работу и при каком газу передаётся большее количество теплоты?
Р е ш е н и е. На диаграмме р—V (рис. 13.10) изобразим все три процесса. Работа численно равна площади криволинейной трапеции. Из рисунка очевидно, что работа при изобарном процессе будет максимальной, при адиабатном минимальной, т. е. A'1 - 2' > A'1—2 > A1—2".
Температура газа в состоянии 2' больше, чем в состоянии 2, а температура в состоянии 2 больше, чем в состоянии 2" (Т2' > Т2 > Т2"). В этом легко убедиться, начертив изотермы, проходящие через точки 2' и 2". При процессе 1—2' изменение внутренней энергии AU > 0, при процессе 1—2 ΔU = 0. Очевидно, что поскольку Q = ΔU + А' (первый закон термодинамики), то Q1-2' > Q2 - 2 > Q1- 2" (Q1 - 2" = 0).
Задача 3. Пусть азот нагревается при постоянном давлении. Зная, что масса азота m = 280 г, количество затраченной теплоты Q = 600 Дж и удельная теплоёмкость азота при постоянном объёме cv = 745 Дж/(кг • К), определите, на сколько повысилась температура азота. Молярная масса азота М = 0,028 кг/моль.
Р е ш е н и е. Согласно первому закону термодинамики Q = ΔU + А'.
Изменение внутренней энергии ΔU = cvmΔT.
Работа при изобарном процессе А' = pΔV = (m/M)RΔT.
Следовательно, Q = mΔT(cv + R/M), откуда
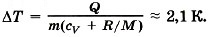
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|