
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
ДОПОЛНИТЕЛЬНЫЕ ГРАФИКИ.. температура измеряется по шкале Цельсия).. СРАВНЕНИЕ ПАРАМЕТРОВ ПО ГРАФИКУ. КОЭФФИЦИЕНТЫ. Внутренняя энергия. й закон термодинамики.
ДОПОЛНИТЕЛЬНЫЕ ГРАФИКИ.
(температура измеряется по шкале Цельсия).


СРАВНЕНИЕ ПАРАМЕТРОВ ПО ГРАФИКУ
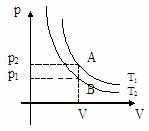
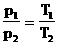 , то Т1>T2.
Чем выше лежит изотерма, тем выше температура.
, то Т1>T2.
Чем выше лежит изотерма, тем выше температура.
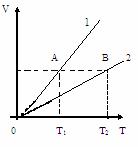
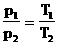 , то р1<р2.
Чем ниже лежит изобара, тем больше давление.
, то р1<р2.
Чем ниже лежит изобара, тем больше давление.
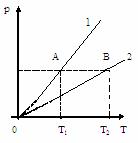
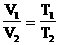 , то V1<V2.
Чем ниже лежит изохора, тем больше объем.
, то V1<V2.
Чем ниже лежит изохора, тем больше объем.
КОЭФФИЦИЕНТЫ
1. Температурный коэффициент объемного расширения. Обозначим V0 - объем газа при 0°С = 273 К. Тогда: 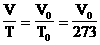 . Обозначим b=1/273 К-1. Следовательно: V=V0bT или V=V0b(t°+273)= V0(1+bt°).
. Обозначим b=1/273 К-1. Следовательно: V=V0bT или V=V0b(t°+273)= V0(1+bt°).
2. Температурный коэффициент давления. Обозначим p0 - давление газа при 0°С = 273 К. Тогда: 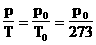 . Обозначим a=1/273 К-1. Следовательно: p=p0aT или p=p0a(t°+273)= p0(1+at°).
. Обозначим a=1/273 К-1. Следовательно: p=p0aT или p=p0a(t°+273)= p0(1+at°).
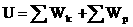
 - внутренняя энергия идеального одноатомного газа.
Внутренняя энергия - однозначная функция состояния (с точностью до произвольной постоянной) и в замкнутой системе сохраняется. Обратное неверно(!) - одной и той же энергии могут соответствовать разные состояния.
- внутренняя энергия идеального одноатомного газа.
Внутренняя энергия - однозначная функция состояния (с точностью до произвольной постоянной) и в замкнутой системе сохраняется. Обратное неверно(!) - одной и той же энергии могут соответствовать разные состояния.
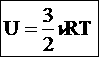
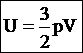
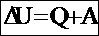
 - другая форма записи первого закона термодинамики.Количество теплоты, переданное системе, идет на изменение ее внутренней энергии и на совершение системой работы над внешними телами.
- другая форма записи первого закона термодинамики.Количество теплоты, переданное системе, идет на изменение ее внутренней энергии и на совершение системой работы над внешними телами.