
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
г. гр.1ТПС-7-21
02.11.2021г. гр.1ТПС-7-21
Дисциплина «Физика»
Преподаватель Бойченко Т.Е.
Занятие № 18
Тема : Модель идеального газа. Давление газа. Связь между давлением и средней кинетической энергией поступательного теплового движения молекул идеального газа
Цель: обучить студентов, давая им систему теоретических знаний, а также практических умений и навыков;
развивать мыслительные способности, их устную и письменную речь, память, воображение, навыки самоорганизации;
содействовать воспитанию нравственных или эстетических убеждений, чувств, волевых и социально-значимых качеств
Модель идеального газа
Идеальный газ – это модель разреженного газа, в которой пренебрегается взаимодействием между молекулами. Силы взаимодействия между молекулами довольно сложны. На очень малых расстояниях, когда молекулы вплотную подлетают друг к другу, между ними действуют большие по величине силы отталкивания. На больших или промежуточных расстояниях между молекулами действуют сравнительно слабые силы притяжения. Если расстояния между молекулами в среднем велики, что наблюдается в достаточно разреженном газе, то взаимодействие проявляется в виде относительно редких соударений молекул друг с другом, когда они подлетают вплотную. В идеальном газе взаимодействием молекул вообще пренебрегают.
Теория создана немецким физиком Р. Клаузисом в 1957 году для модели реального газа, которая называется идеальный газ. Основные признаки модели:
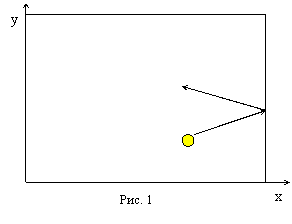 Пусть одна молекула находится в сосуде, имеющем форму прямоугольного параллелепипеда (рис. 1). Рассмотрим, например, удары этой молекулы о правую стенку сосуда, перпендикулярную оси Х. Считаем удары молекулы о стенки абсолютно упругими, тогда угол отражения молекулы от стенки равен углу падения, а величина скорости в результате удара не изменяется. В нашем случае при ударе проекция скорости молекулы на ось У не изменяется, а проекция скорости на ось Х меняет знак. Таким образом, проекция импульса изменяется при ударе на величину, равную Пусть одна молекула находится в сосуде, имеющем форму прямоугольного параллелепипеда (рис. 1). Рассмотрим, например, удары этой молекулы о правую стенку сосуда, перпендикулярную оси Х. Считаем удары молекулы о стенки абсолютно упругими, тогда угол отражения молекулы от стенки равен углу падения, а величина скорости в результате удара не изменяется. В нашем случае при ударе проекция скорости молекулы на ось У не изменяется, а проекция скорости на ось Х меняет знак. Таким образом, проекция импульса изменяется при ударе на величину, равную 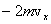 , знак «-» означает, что проекция конечной скорости отрицательна, а проекция начальной – положительна.
Определим число ударов молекулы о данную стенку за 1 секунду. Величина проекции скорости не изменяется при ударе о любую стенку, т.е. можно сказать, что движение молекулы вдоль оси Х равномерное. За 1 секунду она пролетает расстояние, равное проекции скорости , знак «-» означает, что проекция конечной скорости отрицательна, а проекция начальной – положительна.
Определим число ударов молекулы о данную стенку за 1 секунду. Величина проекции скорости не изменяется при ударе о любую стенку, т.е. можно сказать, что движение молекулы вдоль оси Х равномерное. За 1 секунду она пролетает расстояние, равное проекции скорости 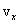 . От удара до следующего удара об эту же стенку молекула пролетает вдоль оси Х расстояние, равное удвоенной длине сосуда 2L. Поэтому число ударов молекулы о выбранную стенку равно . От удара до следующего удара об эту же стенку молекула пролетает вдоль оси Х расстояние, равное удвоенной длине сосуда 2L. Поэтому число ударов молекулы о выбранную стенку равно 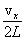 . Согласно 2-му закону Ньютона средняя сила равна изменению импульса тела за единицу времени. Если при каждом ударе о стенку частица изменяет импульс на величину . Согласно 2-му закону Ньютона средняя сила равна изменению импульса тела за единицу времени. Если при каждом ударе о стенку частица изменяет импульс на величину 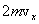 , а число ударов за единицу времени равно , а число ударов за единицу времени равно 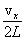 , то средняя сила, действующая со стороны стенки на молекулу (равная по величине силе, действующей на стенку со стороны молекулы), равна , то средняя сила, действующая со стороны стенки на молекулу (равная по величине силе, действующей на стенку со стороны молекулы), равна 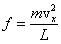 , а среднее давление молекулы на стенку равно , а среднее давление молекулы на стенку равно 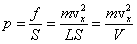 , где V – объем сосуда.
Если бы все молекулы имели одинаковую скорость, то общее давление получалось бы просто умножением этой величины на число частиц N, т.е. , где V – объем сосуда.
Если бы все молекулы имели одинаковую скорость, то общее давление получалось бы просто умножением этой величины на число частиц N, т.е. 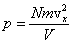 . Но поскольку молекулы газа имеют разные скорости, то в этой формуле будет стоять среднее значение квадрата скорости, тогда формула примет вид: . Но поскольку молекулы газа имеют разные скорости, то в этой формуле будет стоять среднее значение квадрата скорости, тогда формула примет вид: 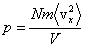 .
Квадрат модуля скорости равен сумме квадратов ее проекций, это имеет место и для их средних значений: .
Квадрат модуля скорости равен сумме квадратов ее проекций, это имеет место и для их средних значений:  . Вследствие хаотичности теплового движения средние значения всех квадратов проекций скорости одинаковы, т.к. нет преимущественного движения молекул в каком-либо направлении. Поэтому . Вследствие хаотичности теплового движения средние значения всех квадратов проекций скорости одинаковы, т.к. нет преимущественного движения молекул в каком-либо направлении. Поэтому 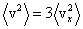 , и тогда формула для давления газа примет вид: , и тогда формула для давления газа примет вид: 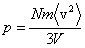 . Если ввести кинетическую энергию молекулы . Если ввести кинетическую энергию молекулы 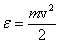 , то получим , то получим 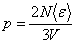 , где , где 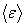 - средняя кинетическая энергия молекулы.
Согласно Больцману средняя кинетическая энергия молекулы пропорциональна абсолютной температуре - средняя кинетическая энергия молекулы.
Согласно Больцману средняя кинетическая энергия молекулы пропорциональна абсолютной температуре 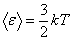 , и тогда давление идеального газа равно , и тогда давление идеального газа равно 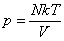 или или
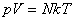 . (1)
Если ввести концентрацию частиц . (1)
Если ввести концентрацию частиц 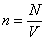 , то формула перепишется так: , то формула перепишется так:
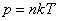 . (2)
Число частиц можно представить в виде произведения числа молей на число частиц в моле, равное числу Авогадро . (2)
Число частиц можно представить в виде произведения числа молей на число частиц в моле, равное числу Авогадро 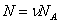 , а произведение , а произведение 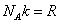 . Тогда (1) запишется в виде: . Тогда (1) запишется в виде:
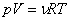 . (3)
Уравнения (1), (2) и (3) – это разные формы записи уравнения состояния идеального газа, они связывают давление, объем и температуру газа. Эти уравнения применимы как к чистым газам, так и к смесям газов, в последнем случае под N, n и ν следует понимать полное число молекул всех сортов, суммарную концентрацию или полное число молей в смеси. Для чистого газа число молей . (3)
Уравнения (1), (2) и (3) – это разные формы записи уравнения состояния идеального газа, они связывают давление, объем и температуру газа. Эти уравнения применимы как к чистым газам, так и к смесям газов, в последнем случае под N, n и ν следует понимать полное число молекул всех сортов, суммарную концентрацию или полное число молей в смеси. Для чистого газа число молей 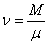 , где М – масса газа, а μ – масса одного моля (молярная масса). Тогда уравнение (3) примет вид: , где М – масса газа, а μ – масса одного моля (молярная масса). Тогда уравнение (3) примет вид:
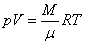 . (4)
Уравнение состояния в этой форме называют уравнением Клапейрона–Менделеева.
Рассмотрим частные газовые законы. При постоянной температуре и массе из (4) следует, что . (4)
Уравнение состояния в этой форме называют уравнением Клапейрона–Менделеева.
Рассмотрим частные газовые законы. При постоянной температуре и массе из (4) следует, что 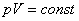 , т.е. при постоянной температуре и массе газа его давление обратно пропорционально объему. Этот закон называется законом Бойля и Мариотта, а процесс, при котором температура постоянна, называется изотермическим.
Для изобарного процесса, происходящего при постоянном давлении, из (4) следует, что , т.е. при постоянной температуре и массе газа его давление обратно пропорционально объему. Этот закон называется законом Бойля и Мариотта, а процесс, при котором температура постоянна, называется изотермическим.
Для изобарного процесса, происходящего при постоянном давлении, из (4) следует, что 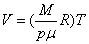 , т.е. объем пропорционален абсолютной температуре. Этот закон называют законом Гей-Люссака.
Для изохорного процесса, происходящего при постоянном объеме, из (4) следует, что , т.е. объем пропорционален абсолютной температуре. Этот закон называют законом Гей-Люссака.
Для изохорного процесса, происходящего при постоянном объеме, из (4) следует, что 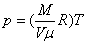 , т.е. давление пропорционально абсолютной температуре. Этот закон называют законом Шарля.
Эти три газовых закона, таким образом, являются частными случаями уравнения состояния идеального газа. Исторически они сначала были открыты экспериментально, и лишь значительно позднее получены теоретически, исходя из молекулярных представлений. , т.е. давление пропорционально абсолютной температуре. Этот закон называют законом Шарля.
Эти три газовых закона, таким образом, являются частными случаями уравнения состояния идеального газа. Исторически они сначала были открыты экспериментально, и лишь значительно позднее получены теоретически, исходя из молекулярных представлений.
|
Домашнее задание:
1. Записать в конспект дату и тему занятия.
2. Внимательно изучить лекцию
3. Выписать в конспект уравнением Клапейрона–Менделеева
3. При возникновении вопросов связаться с преподавателем
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|