
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
ПРАКТИЧЕСКАЯ РАБОТА №3. Тема: «Расчеты тепловых эффектов химической реакции». ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
ПРАКТИЧЕСКАЯ РАБОТА №3
Тема: «Расчеты тепловых эффектов химической реакции»
Цель работа:Закрепить понятие первого закона термодинамики, закона сохранения энергии распространённого на тепловые явления.
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
Первый закон термодинамики – это закон сохранения и превращения энергии. Закон является всеобщим, и приложим к любым процессам, в том числе и к химическим реакциям и фазовым превращениям.
Q = U+ A,
где Q – теплота,
U – изменение внутренней энергии
A – работа
Если в результате реакций тепло выделяется, то тепловой эффект Н< 0 (реакция экзотермическая), при поглощении тепла Н> 0 (реакция эндотермическая).
U = Q – A
Работа – это передача энергии под действием силы, направленной от источника работы к ее приемнику, сопровождается изменением движения
При изотермическом сжатии газа работа равна:A = RT∙ ln( 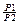 )
)
При изотермическом расширении газа: 
При изохорном процессе: 
Теплота – это передача энергии под действием разности температур взаимодействующих тел.
Теплота положительна, если она сообщается окружающей средой систем, теплота отрицательна, если она сообщается системой окружающей среде.
Теплоемкость –теплота процесса в результате которого температура системы изменяется на 1К.
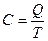

 [Дж/К]
[Дж/К]
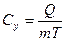 [Дж/кг∙К] удельная теплоемкость ;
[Дж/кг∙К] удельная теплоемкость ; 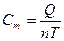 [Дж/моль∙К] мольная теплоемкость ;
[Дж/моль∙К] мольная теплоемкость ;
 [Дж/м3∙К] объёмная теплоемкость
[Дж/м3∙К] объёмная теплоемкость
Зависимость между теплоемкостями: Сm=Cy∙M ;Соб=Су∙ρ ;
 =
= 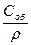 ;
;
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|