
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
РЕШЕНИЕ ТИПОВЫХ ЗАДАЧ ПО ТЕМЕ “ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА И ТЕРМОХИМИЯ” (для нехимических специальностей)
РЕШЕНИЕ ТИПОВЫХ ЗАДАЧ ПО ТЕМЕ “ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА И ТЕРМОХИМИЯ” (для нехимических специальностей)
1. Рассчитайте ΔHo298 химической реакции Na2O(т) + H2O(ж) → 2NaOH(т)
по значениям стандартных теплот образования веществ ( 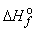 , см. таблицу 1 приложения). Укажите типреакци (экзо- или эндотермическая).
, см. таблицу 1 приложения). Укажите типреакци (экзо- или эндотермическая).
Решение
По данным таблицы 1 приложения, стандартные энтальпии образования Na2O(т), H2O(ж) и NaOH(т) при 298К равны соответственно –416, –286 и –427,8 кДж/моль. Используя следствие из закона Гесса, рассчитываем ΔHo298 химической реакции:
ΔHo298 = 2 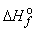 (NaOH,т) – [
(NaOH,т) – [ 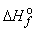 (Na2O,т) +
(Na2O,т) + 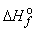 (H2O,ж)] = 2·(– 427,8) –
(H2O,ж)] = 2·(– 427,8) –
– [–416 + (–286)] = –153,6 кДж.
Ответ: –153,6 кДж.
2. Определите, как изменяется энтропия при протекании химического процесса Na2O(т) + H2O(ж) → 2NaOH(т).
Решение.
В данном процессе при взаимодействии 1 моль кристаллического и 1 моль жидкого вещества образуется 2 моль кристаллического вещества. Следовательно, система переходит в состояние с меньшим беспорядком, и энтропия уменьшается (ΔS< 0).
Ответ: уменьшается.
3. Рассчитайте величину ΔSo298для процесса
Na2O(т) + H2O(ж) → 2NaOH(т), используя значения стандартных энтропий веществ (см. таблицу 1 приложения).
Решение.
Используя справочные данные: So(NaOH,т) = 64,16 Дж/(моль·К),
So(Na2O,т) = 75,5 Дж/(моль·К), So(H2O,ж) = 70 Дж/(моль·К), рассчитываем ΔSo298:
ΔSo298 = 2·So(NaOH,т) – [So(Na2O,т) + So(H2O,ж)] = 2·64,16 – (75,5 + 70) =
= – 17,18 Дж/К.
Ответ: –17,18 Дж/К.
4. Рассчитайте изменение энергии Гиббса (ΔGo298) для процесса
Na2O(т) + H2O(ж) → 2NaOH(т) по значениям стандартных энергий Гиббса образования веществ (см. таблицу 1 приложения). Возможно ли самопроизвольное протекание реакции при стандартных условиях и 298К ?
Решение:
При стандартных условиях и T=298К ΔGo298 можно рассчитать как разность суммарной энергии Гиббса образования продуктов реакции и суммарной энергии Гиббса образования исходных веществ. Необходимые справочные данные: 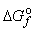 (NaOH,т)= –381,1 кДж/моль,
(NaOH,т)= –381,1 кДж/моль, 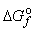 (Na2O)= –378 кДж/моль,
(Na2O)= –378 кДж/моль, 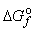 (H2O,ж) = –237 кДж/моль.
(H2O,ж) = –237 кДж/моль.
ΔGo298 = 2· 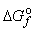 (NaOH,т) – [
(NaOH,т) – [ 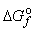 (Na2O,т) +
(Na2O,т) + 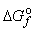 (H2O,ж)] = 2·(–381,1) –
(H2O,ж)] = 2·(–381,1) –
– [–378 + (–237)] = –147,2 кДж.
Значение ΔGo298 отрицательно, поэтому самопроизвольное протекание реакции возможно.
Ответ: –147,2 кДж; возможно.
5. Определите, возможно ли при 95oС самопроизвольное протекание процесса Na2O(т) + H2O(ж) → 2NaOH(т). Ответ обоснуйте, рассчитав величину изменения энергии Гиббса приданной температуре.
Решение:
Переведем температуру в шкалу Кельвина: Т=273+95=368К. Для расчета ΔGo368 воспользуемся уравнением:
ΔGo368=ΔHo – TΔSo
Воспользуемся изменениями энтальпии и энтропии, рассчитанными для данного процесса в предыдущих задачах. При этом величину изменения энтропии необходимо перевести из Дж/К в кДж/К, поскольку значения ΔH и ΔG обычно измеряют в кДж.
–17,18 Дж/К = –0,01718 кДж/К
ΔGo368 = –153,6 – 368·(–0,01718) = –147,3 кДж.
Таким образом, ΔGo368< 0, поэтому самопроизвольное протекание данного процесса при 95oС возможно.
Ответ: –147,3 кДж; возможно.
6. Составьте термохимическое уравнение реакции взаимодействия Na2O(т) и H2O(ж), если при этом образуется 1 моль NaOH(т). В ответе приведите количество теплоты, указанное в термохимическом уравнении.
Решение:
Коэффициенты в термохимическом уравнении имеют смысл молей. Поэтому допустимы дробные значения коэффициентов. 1 моль гидроксида натрия может образоваться из 1/2 моля оксида натрия и 1/2 моля воды. В задании 1 (см. выше) рассчитано, что при образовании 2 моль NaOH в данной реакции выделяется 153,6 кДж теплоты (ΔHo298 = –153,6 кДж). Поэтому при образовании 1 моль NaOH количество выделившейся теплоты будет в 2 раза меньше, т.е. 76,8 кДж. В термохимическом уравнении количество выделяющейся теплоты указывают со знаком “плюс”: 1/2 Na2O(т) + 1/2 H2O(ж) → NaOH(т) + 76,8 кДж.
Ответ: +76,8 кДж.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|