
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
ОПОРНЫЙ КОНСПЕКТ ПО ТЕМЕ «ЭД». Кислоты – это сложные вещества, при диссоциации которых в водных растворах в качестве катионов образуются только ионы водорода.
ОПОРНЫЙ КОНСПЕКТ ПО ТЕМЕ «ЭД»
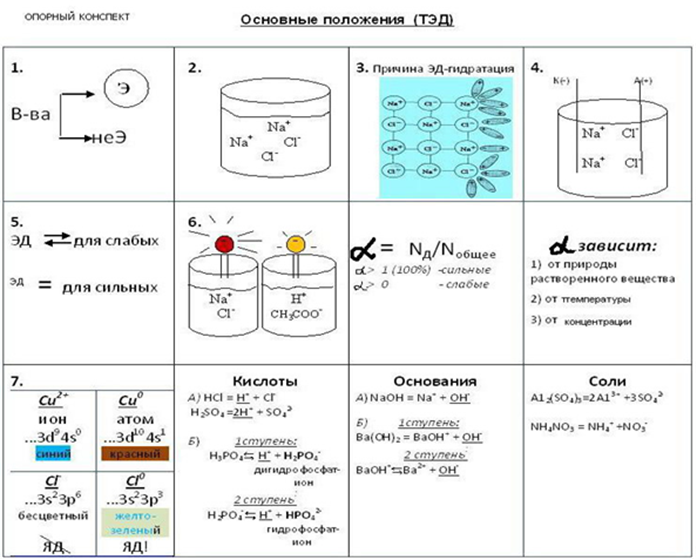
1. Все вещества делятся на электролиты и неэлектролиты. ТЭД изучает электролиты.
2. При растворении в воде эл-ты диссоциируют на ионы.
3. Причина диссоциации – гидратация, то есть взаимодействие электролита с молекулами воды и разрыв химической связи в нем.
4. Под действием эл. тока + ионы(катионы) движутся к катоду, а отрицательные (анионы) к аноду.
5. ЭД обратима для слабых электролитов.
6. Не все электролиты в одинаковой степени диссоциируют на ионы. Поэтому они делятся на сильные и слабые и характеризуются степенью диссоциации, которая зависит от разных причин.
7. Химические свойства растворов электролитов определяются свойствами тех ионов, которые они образуют при диссоциации.
8. По характеру образующихся ионов различают 3 типа электролитов.
9. Диссоциация кислот, щелочей и солей в водных растворах.
Кислоты – это сложные вещества, при диссоциации которых в водных растворах в качестве катионов образуются только ионы водорода.
H2SO4 ↔ H+ + SO42-
Щелочи – это сложные вещества, при диссоциации которых в водных растворах образуются только гидроксид-ионы.
Са(ОН)2 ↔ Са2++2ОН-
Средние соли – это сложные вещества, при диссоциации которых в водных растворах образуются катионы металлов и анионы кислотных остатков.
CaCl2 ↔ Ca+2 + 2Cl-
Кислые соли – это сложные вещества, при диссоциации которых в водных растворах образуются катионы металла и водорода, а так же анионы кислотных остатков.
KHSO4 ↔ K + + H+ + SO42-
Основные соли - это сложные вещества, при диссоциации которых в водных растворах образуются катионы металла и анионы водорода и гидроксид-ионы.
Mg(OH)Cl = MgOH+ + Cl-
MgOH+ = Mg +2 + OH-
Реакции обмена идут до конца в 3 случаях. Если НЕ образуются осадок, газ и вода, то реакции являются обратимымина ионы никогда не раскладывают : нерастворимые вещества (см. таблицу растворимости);оксиды; воду; газы
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|