
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Расчёт по реакциям окисления
Расчёт 2
Обжиг медного концентрата
Условия расчётов
1. Обжиг проводиться в печи КС, следовательно FeS окисляется до Fe3O4, при десульфуризации 70%
2. Если цинка более 2%, то он окисляется на 50%
3. Коэффициент избытка воздуха составляет 1,2
4. Температура в печи 8500С
5. Температура огарка 7500С
6 .Температура газов 8000С
7. Внутренний диаметр печи 6,5 м
8. Внутренняя высота печи 9 м
9. Печь футерована шамотом 250 мм
10.Теплоизоляция из асбеста 25 мм
11. Кожух из стали 15 мм
8. Удельная производительность печи по концентрату 24 т/м2*сут
Таблица 1-Фазовый состав медного концентрата
| минералы | CuFeS2 | CuS | ZnS | FeS2 | Fe7S8 | SiO2 | CaO | Al2O3 | прочие | итого |
| Cu | 6,50 | 3,5 |
|
|
|
|
|
|
| 10,00 |
| Fe | 5,71 |
|
| 18,29 |
|
|
|
| 28,00 | |
| S | 6,56 | 1,76 | 7,10 | 20,96 | 2,62 |
|
|
|
| 39,00 |
| Zn |
|
| 14,5 |
|
|
|
|
|
| 14,5 |
| SiO2 |
|
|
|
|
| 1,8 |
|
|
| 1,8 |
| Cao |
|
|
|
|
|
| 0,2 |
|
| 0,2 |
| Al2O3 |
|
|
|
|
|
|
|
| ||
| прочие |
|
|
|
|
|
|
|
| 3,50 | 3,50 |
| итого | 18,77 | 5,26 | 21,60 | 39,25 | 6,62 | 1,8 | 0,2 | 3,50 | 100,00 |
2 Расчёт реакций диссоциации высших сульфидов
2 CuFeS2 = Cu2S+2 FeS+Sп (1)
2 CuS = Cu2S+Sп (2)
FeS2 = FeS+Sп (3)
Fe7S8=7 FeS+Sп (4)
2.1 Расчёт по реакции (1) (Количество CuFeS2 берётся из таблицы № 1)
Расчёт количество Cu2S
2 CuFeS2 Cu2S
2*kMr: 2 * 183,3 кг 1*kMr: 1 * 159 кг m:Cu2S 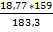 = 8,141 кг
= 8,141 кг
m: 18,77 кг m:Cu2S кг
Количество 2*FeS
2*CuFeS2 2*FeS
2*kMr: 2 * 183,3 кг 2*kMr: 2 * 87,8 кг m: FeS = 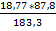 8,991 кг
8,991 кг
m: 18,77 кг m: FeS кг
Количество S
2*CuFeS2 S
2*kMr: 2 * 183,3 кг 1*kMr: 1 * 32 кг mS = 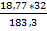 1,638 кг
1,638 кг
m: 18,77 кг mS
Проверка:
mCu2S+mFeS+mS=mCuFeS2
ИСТИНА
2.2 Расчёт по реакции (2) (Количество CuS берётся из таблицы № 1)
Количество CuS
2*CuS Cu2S
2*kMr: 2 * 95,5 кг 1*kMr: 1 * 159 кг mCu2S = 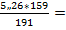 4,379 кг
4,379 кг
m: 5,26 кг mCu2S:
Количество S
2*CuS S
2*kMr: 2 * 95,5 кг 1*kMr: 1 * 32 кг mS = 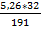 =0,881 кг
=0,881 кг
m: 5,26 кг mS:
Проверка:
mCu2S+mS=mCu2S
ИСТИНА
2.3 Расчёт по реакции (3) (Количество FeS берётся из таблицы № 1)
Количество FeS
FeS2 FeS
1*kMr: 1 * 119,8 кг 1*kMr: 1 * 87,8 кг mFeS = 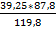 =28,766 кг
=28,766 кг
m: 39,25 кг mFeS:
Количество S
FeS2 S
1*kMr: 1 * 119,8 кг 1*kMr: 1 * 32 кг mS = 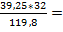 10,484 кг
10,484 кг
m: 39,25 кг mS:
Проверка:
mFeS+mS=mFeS2
ИСТИНА
2.4 Расчёт по реакции (4) (Количество Fe7S8 берётся из таблицы № 1)
Количество FeS
Fe7S8 7*FeS
1*kMr: 1 * 646,6 кг 7*kMr: 7 * 87,8 кг mFeS = 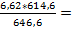 6,292 кг
6,292 кг
m: 6,62 кг mFeS:
Количество S
Fe7S8 S
1*kMr: 1 * 646,6 кг 1*kMr: 1 * 32 кг mS = 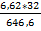 =0,328 кг
=0,328 кг
m: 6,62 кг mS:
Проверка:
mFeS+mS=mFe7S8
ИСТИНА
Итого по реакциям диссоциации получено:
Cu2S: 8,141 + 4,379 = 12,520 кг (Масса Cu2S из реакция (1) + масса Cu2S из реакции (2) )
FeS: 8,991 + 28,766 + 6,292 = 44,049 кг (FeSиз реакция (1) +FeSиз реакции (3)+ FeSиз реакции (4 )
S(п): 1,638 + 0,881 + 10,484 + 0,328 = 13,331 кг (Сера по всем реакциям (1) +(2) +(3)+(4) )
Общая проверка:
18,77 + 5,26 + 39,25 + 6,62 = 12,520 + 44,049 + 13,331
Расчёт по реакциям окисления
2ZnS+302=2ZnO+2SO2 (5)
3FeS+5O2=Fe3O4+3SO2 (6)
S+O2=SO2 (7)
Всего по реакциям диссоциации получено S(п)= 13,331 кг тогда за счёт окисления S, должно удалиться:
mS(ок) = m S(к-та) * 0,7 – m S(д) = 39,00 * 0,7 - 13,331 = 13,96857483 кг
Т.к. Zn больше 2%, то он окисляется на 50%, т.е. 21,60 * 0,5 = 10,8 кг
3.1 Расчёт по реакции (5)
Количество O2
2ZnS 3O2
2*kMr: 2 * 97,3 кг 3*kMr: 3 * 32 кг mO2= 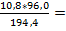 5,328 кг
5,328 кг
m: 10,8 кг mO2:
Количество 2ZnO
2ZnS 2ZnO
2*kMr: 2 * 97,3 кг 2*kMr: 2 * 81,3 кг mZnO = 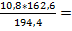 9,024 кг
9,024 кг
m: 10,8 кг mZnO: X кг
2ZnS 2SO2
2*kMr: 2 * 97,3 кг 2*kMr: 2 * 64 кг mSO2 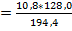 = 7,104 кг
= 7,104 кг
m: 10,8 кг mSO2:
Проверка:
mZnS+mO2=mZnO+mSO2
ИСТИНА
3.2 Расчёт по реакции 6
mSFeS = m S(ок) – mSZnS = 13,969 - 3,55 = 10,419 кг
Количество FeS
3S 3FeS
3*kMr: 3 * 32 кг 3*kMr: 3 * 87,8 кг mFeS =  = 28,586 кг
= 28,586 кг
m: 10,419 кг mFeS
3FeS 5O2
3*kMr: 3 * 87,8 кг 5*kMr: 5 * 32 кг mO2 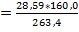 = 17,364 кг
= 17,364 кг
m: 28,586 кг mO2
количес тво Fe3O4
3FeS Fe3O4
3*kMr: 3 * 87,8 кг 1*kMr: 1 * 231,4 кг mFe3O4 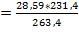 = 25,113 кг
= 25,113 кг
m: 28,586 кг mFe3O4
Количество SO2
3FeS 3SO2
3*kMr: 3 * 87,8 3*kMr: 3 * 64 кг X= 20,837 кг
m: 28,586 кг m: X кг
Проверка:
mFeS + mO2 = mFe3O4 + mSO2
ИСТИНА
3.3 Расчёт по реакции 7
Количество O2
S O2
1*kMr: 1 * 32 кг 1*kMr: 1 * 32 кг mO2 = 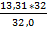 = 13,331 кг
= 13,331 кг
m: 13,331 кг mO2:
Количество SO2
S S02
1*kMr: 1 * 32 кг 1*kMr: 1 * 64 кг mSO2 = 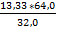 = 26,663 кг
= 26,663 кг
m: 13,331 кг mSO2:
Проверка:
mS + mO2 = mSO2
ИСТИНА
Итого по реакциям окисления получено:
mZnO: 9,024 кг
mFe3O4: 25,113 кг
mSO2: 7,104 + 20,837 + 26,663 = 54,604 кг
В огарок переходит mFeS = m FeS(д) – m FeS(ок) = 44,049 - 28,586 = 15,463 кг
4 Расчет компонентов, входящих в состав огарка
4.1 Расчёт Cu2S
Количество Cu
Cu2S 2Cu
1*kMr: 1 * 159 кг 2*kMr: 2 * 63,5 кг mCu = 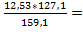 10,000 кг
10,000 кг
m: 12,520 кг mCu:
Количество S
Cu2S S
1*kMr: 1 * 159 кг 1*kMr: 1 * 32 кг mS = 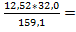 2,520 кг
2,520 кг
m: 12,520 кг mS:
Проверка:
mCu + mS = mCu2S
ИСТИНА
4.2 Расчет FeS
Количество Fe
FeS Fe
1*kMr: 1 * 87,8 кг 1*kMr: 1 * 55,8 кг mFe = 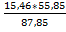 = 9,827 кг
= 9,827 кг
m: 15,463 кг mFe:
Количество S
FeS S
1*kMr: 1 * 87,8 кг 1*kMr: 1 * 32 кг mS = 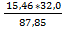 =5,636 кг
=5,636 кг
m: 15,463 кг mS:
Проверка:
mFe + mS = mFeS
ИСТИНА
4.3 Расчет Fe3O4
Количество Fe
Fe3O4 3Fe
1*kMr: 1 * 231,4 кг 3*kMr: 3 * 55,8 кг mFe = 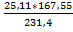 =18,167 кг
=18,167 кг
m: 25,113 кг mFe:
Количество O
Fe3O4 4O
1*kMr: 1 * 231,4 кг 4*kMr: 4 * 16 кг mO = 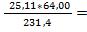 6,946 кг
6,946 кг
m: 25,113 кг mO:
Проверка:
mFe + mO = mFe3O4
ИСТИНА
4.5 Расчет ZnS
Количество Zn
ZnS Zn
1*kMr: 1 * 97,3 кг 1*kMr: 1 * 65,3 кг mZn = 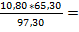 7,248 кг
7,248 кг
m: 10,80 кг mZn:
Количество S
ZnS S
1*kMr: 1 * 97,3 кг 1*kMr: 1 * 32 кг mS = 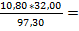 3,552 кг
3,552 кг
m: 10,80 кг mS:
Проверка:
mZn + mS = mZnS
ИСТИНА
4.5 Расчет ZnO
Количество Zn
ZnO Zn
1*kMr: 1 * 81,3 кг 1*kMr: 1 * 65,3 кг mZn = 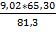 = 7,248 кг
= 7,248 кг
m: 9,024 кг mZn:
Количество O
ZnO O
1*kMr: 1 * 81,3 кг 1*kMr: 1 * 16 кг mO = 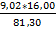 = 1,776 кг
= 1,776 кг
m: 9,024 кг mO:
Проверка:
mZn + mO = mZnO
ИСТИНА
Таблица 2 -Фазовый состав огарка
|
| Cu2S | FeS | Fe3O4 | ZnS | ZnO | SiO2 | CaO | Al2O3 | Прочие | Итого |
| |||||||||
| кг | % | кг | % | кг | % | кг | % | кг | % | кг | % | кг | % | кг | % | кг | % | кг | % | |
| Cu | 10,00 | 12,28 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| 10,00 | 12,28 |
| Zn |
|
|
|
|
|
| 7,25 | 8,90 | 7,25 | 8,90 |
|
|
|
|
|
|
|
| 14,50 | 17,80 |
| Fe |
|
| 9,83 | 12,07 | 18,17 | 22,31 |
|
|
|
|
|
|
|
|
|
|
|
| 27,99 | 34,38 |
| S | 2,52 | 3,09 | 5,64 | 6,92 |
|
| 3,55 | 4,36 |
|
|
|
|
|
|
|
|
|
| 11,71 | 14,38 |
| O2 |
|
|
|
| 6,95 | 8,53 |
|
| 1,78 | 2,18 |
|
|
|
|
|
|
|
| 8,72 | 10,71 |
| SiO2 |
|
|
|
|
|
|
|
|
|
| 1,80 | 2,21 |
|
|
|
|
|
| 1,80 | 2,21 |
| CaO |
|
|
|
|
|
|
|
|
|
|
|
| 0,20 | 0,25 |
|
|
|
| 0,20 | 0,25 |
| Al2O3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
| 3,00 | 3,68 |
|
| 3,00 | 3,68 |
| Прочие |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| 3,50 | 4,30 | 3,50 | 4,30 |
| Итого | 12,52 | 15,38 | 15,46 | 18,99 | 25,11 | 30,84 | 10,80 | 13,26 | 9,02 | 11,08 | 1,80 | 2,21 | 0,20 | 0,25 | 3,00 | 3,68 | 3,50 | 4,30 | 81,42 | 100,00 |
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|