
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Лекция №10. Водородная химическая связь.
Лекция №10
Водородная химическая связь.
Водородная связь – это своеобразная химическая связь. Она может быть межмолекулярной и внутримолекулярной.
Межмолекулярная водородная связь возникает между молекулами, в состав которых входят водород и сильно электроотрицательный элемент – фтор, кислород, азот, реже хлор и сера. В такой молекуле общая электронная пара сильно смещена от водорода к атому электроотрицательного элемента, а положительный заряд водорода сконцентрирован в малом объеме, то протон взаимодействует с неподеленной парой другого атома или иона, обобществляя ее. В результате образуется вторая, более слабая связь, получившая название водородной. Ранее водородную связь сводили к электростатическому притяжению между протоном и другой полярной группой. Но более правильным следует считать, что в ее образование вносит вклад и донорно-акцепторное взаимодействие. Для этой связи характерны направленность в пространстве и насыщаемость.
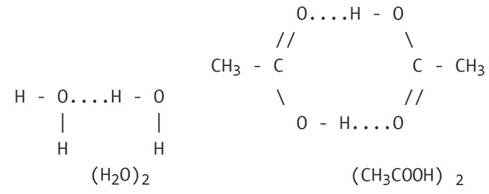
Обычно водородную связь обозначают точками и этим указывают, что она намного, слабее ковалентной связи (примерно в 15-20 раз). Тем не менее, она ответственна ассоциацию молекул. Например, образование димеров (в жидком состоянии они наиболее устойчивы) воды и уксусной кислоты можно представить схемами:
Наличием водородных связей объясняется более высокая температура кипения воды (100⁰С) по сравнению с водородными соединениями элементов подгруппы кислорода (H₂S - 60⁰C, H₂Se - 42⁰C) В случае воды надо затратить дополнительную энергию на разрушение водородных связей.
Сильные водородные связи между молекулами воды препятствуют ее плавлению и испарению. Водородные связи являются причиной и другого уникального свойства воды – при плавлении ее плотность возрастает. В структуре льда каждый атом кислорода связан через атомы с другими атомами кислорода – из других молекул воды. В результате образуется очень рыхлая «ажурная» структура. Вот почему лед такой легкий. При плавлении льда 10%водородных связей разрушается, и молекулы воды немного сближаются. Поэтому плотность жидкой воды при температуре плавления выше, чем плотность льда. Дальнейшее нагревание, с одной стороны, должно вызывать увеличение объема воды. Это происходит со всеми веществами. Но, с другой стороны, водородные связи продолжают разрушаться, а это должно приводить к уменьшению объема воды. В результате плотность воды изменяется неравномерно. Наибольшее значение она имеет при температуре 4⁰С. Такова зимняя температура вблизи дна пресноводных водоемов, где скапливается вода с максимальной плотностью.
При замерзании вода расширяется и занимает большой объем. Плотность льда меньше, чем плотность жидкой воды. Поэтому лед плавает на поверхности воды. Если бы у льда была более высокая плотность, по мере замерзания он опускался бы на дно, что сделало бы жизнь в водоемах зимой невозможной.
Особенно распространены водородные связи в молекулах белков, нуклеиновых кислот и других биологически важных соединений, а поэтому эти связи играют важную роль в химии процессов жизнедеятельности.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|