
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
государственное образовательное учреждение высшего профессионального образования
государственное образовательное учреждение высшего профессионального образования
«ДОНЕЦКИЙ НАЦИОНАЛЬНЫЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ»
Кафедра «Прикладная экология и охрана окружающей среды»
ИНДИВИДУАЛЬНАЯ РАБОТА
по дисциплине: «Физическая химия тугоплавких неметаллических и силикатных материалов »
на тему «Практическое применение диаграмм состояния 2-х и 3-х компонентных систем»
Студентки 3 курса
группы ТТМск -19
направления подготовки: 18.03.01 «Химическая технология»
Смоляк К.И.
Принял: профессор Прилипко Ю.С.
(должность, ученое звание, научная степень, Ф.И.О.)
Национальная шкала_____________
Количество баллов:______________
Оценка: ЕСТS__________________
г. Донецк – 2021
СОДЕРЖАНИЕ
ВВЕДЕНИЕ
1 двухкомпонентная система TiO2 – SiO2 6
1.1 Элементы строения диаграммы состояния TiO2 – SiO2 6
1.2 Общие сведения. 7
1.3 Область применения TiO2 – SiO2 10
2 двухкомпонентная система ZnO – B2O3 11
2.1 Общая характеристика системы.. 11
2.2 Элементы строения диаграммы состояния ZnO – B2O3 12
2.3 Правила работы с диаграммой ZnO – B2O3 15
2.3.1 Определения содержания компонентов в исходном составе и в конечных фазах кристаллизации. 15
2.4 Практическое применение в промышленности. 16
3 Трехкомпонентная система MgO – Al2O3 – SiO2 17
3.1 Общая характеристика системы.. 19
3.2 Элементы строения диаграммы состояния MgO – Al2O3 – SiO2 22
3.3 Применение правила рычага в трехкомпонентных системах. 26
3.4 Определение содержания компонентов на основе треугольника концентраций 29
3.5 Практическое применение в промышленности. 29
4 РЕШЕНИЕ ЗАДАЧ ПО ДВУХКОМПОНЕНТНОЙ СИСТЕМЕ. 39
4.1 Задача № 70. 39
4.2 Задача № 72. 41
5 РЕШЕНИЕ ЗАДАЧ ПО ТРЕХКОМПОНЕНТНОЙ СИСТЕМЕ. 43
5.1 Задача № 70. 43
5.2 Задача № 71. 43
ВЫВОДЫ
СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ
Реферат
Курсовая работа
страниц - , таблиц- , иллюстраций - , источников –
Цель работы: изучить фазовые диаграммы состояния двух- и трехкомпонентных систем, их промышленное применение, а также освоить навыки работы с системами тугоплавких веществ.
В работе описаны основные характеристики, элементы строения, правила работы с фазовой диаграммой двухкомпонентной системы TiO2 – SiO2, ZnO – B2O3 и трехкомпонентной MgO – Al2O3 – SiO2, также рассмотрены области их практического применения. Приведено решение задач с целью усвоения и отработки практических навыков работы с диаграммами состояние.
ДИАГРАММА СОСТОЯНИЯ, ЭВТЕКТИКА, ЛИКВИДУС, СОЛИДУС, МОДИФИКАЦИЯ, ИЗОТЕРМА, СИЛИКАТЫ, РАСТВОР, ФАЗА.
Report
pages - , tables- , illustrations - , sources –
The purpose of the work: to study the phase diagrams of the state of two- and three-component systems, their industrial application, as well as to master the skills of working with systems of refractory substances.
The paper describes the main characteristics, structural elements, rules for working with the phase diagram of the two-component TiO2 – SiO2, ZnO – B2O3 and three–component MgO – Al2O3 - SiO2 systems, and also considers the areas of their practical application. The solution of problems is given in order to assimilate and practice practical skills of working with state diagrams.
STATE DIAGRAM, EUTECTIC, LIQUIDUS, SOLIDUS, MODIFICATION, ISOTHERM, SILICATES, SOLUTION, PHASE.
ВВЕДЕНИЕ
Термодинамические данные о свойствах равновесных фаз могут быть представлены с помощью диаграмм состояния. На основе данных о термодинамических свойствах равновесных фаз можно осуществлять разработку технологий многих важных продуктов, в частности силикатов. Эти данные позволят достигнуть оптимальных параметров технологических процессов, определить состав и ожидаемые свойства материалов, оценить стабильность синтетических продуктов и т. д.
Диаграммы состояния необходимы для исследования поведения объектов в системе и дают полную информацию о них. Изучение диаграмм состояния, представленных в данной работе (TiO2 – SiO2, ZnO – B2O3 и MgO – Al2O3 – SiO2) в настоящие время имеет большое значения, так как они играют важную роль в технологии при производстве теплоизоляционных материалов, шамотных и высокоглиноземистых огнеупоров, стекла, тонкой керамики и других важных технических продуктов.
Рассмотрение подробного описания приемов и правил работы с изучаемыми диаграммами состояния, а также их основных элементов строения, позволяют определять направления и характер процессов, происходящих в системах при изменении температуры, состава и концентрации в продуктах отдельных фаз.
Цель курсовой работы: изучить строение изучаемых диаграмм двухкомпонентных и трехкомпонентных систем, получить навыки работы с ними путем решения задач, описать основные способы практического применения в различных отраслях науки и техники.
Изучение представленных диаграмм состояния позволит на практике решать множество производственных задач, подбирать условия промышленного синтеза веществ, определять направленность процессов, связанных с фазовыми переходами, осуществлять выбор режимов термообработки, отыскивать оптимальные составы фаз и прочее.
1 двухкомпонентная система TiO2 – SiO2
1.1 Элементы строения диаграммы состояния TiO2 – SiO2
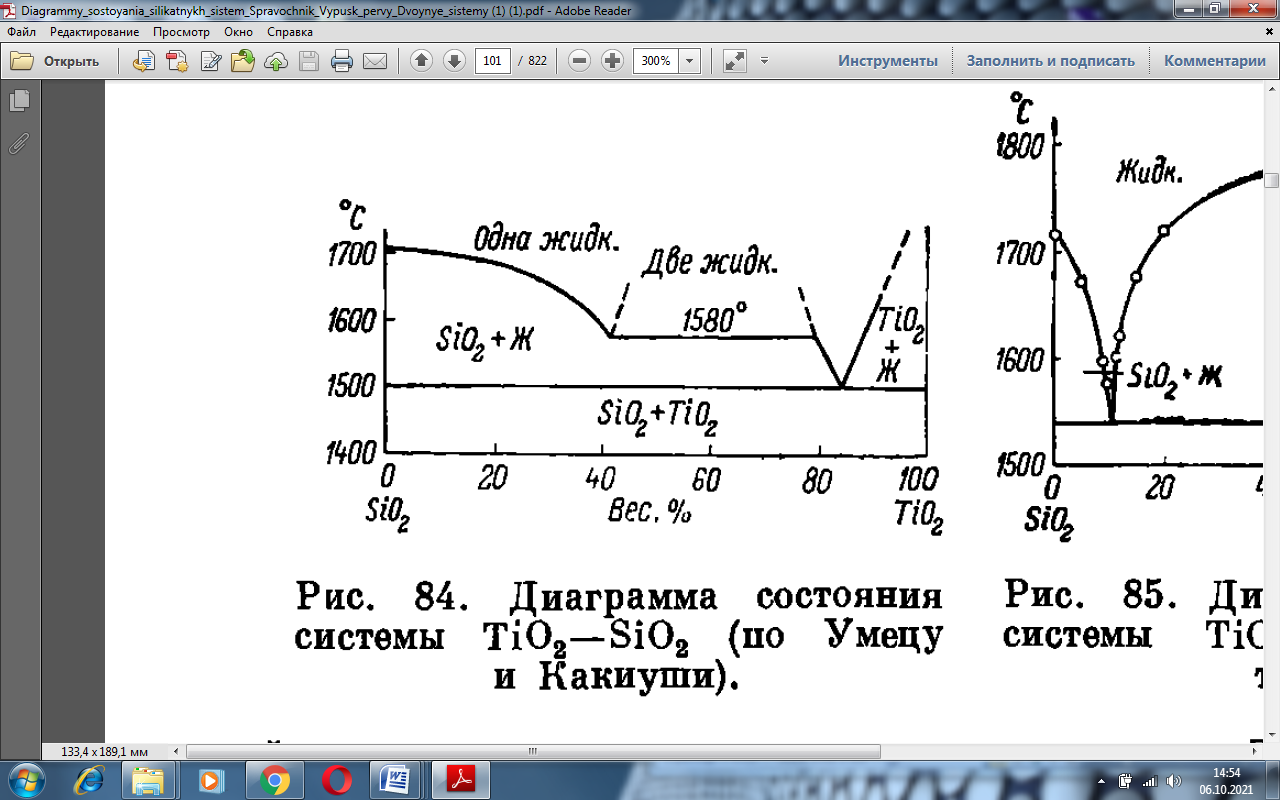
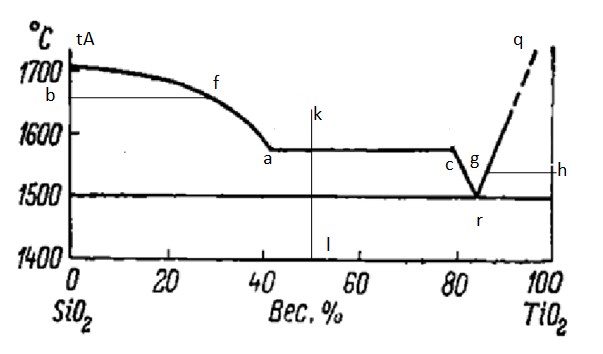 Рисунок 1.1 –Диаграммы состояния TiO2 – SiO2
Рисунок 1.1 –Диаграммы состояния TiO2 – SiO2
Рисунок 1.2 – Элементы строения диаграммы состояния TiO2 – SiO2
На рисунке 1.2 изображена система TiO2 – SiO2, с помощью которой можно рассмотреть основные элементы строения данной диаграммы [1].
Координатные оси – рассматриваемая диаграмма построена в координатах температура (ось ординат) – концентрация компонентов (ось абсцисс). Цифры на оси абсцисс указывают на содержание компонента в % (масс.). Точки SiO2 и TiO2 в начале и в конце оси абсцисс соответствуют 100% содержанию этих компонентов [2].
Вертикали составов и изотермы – перпендикуляр, опущенный из любой фигуративной точки диаграммы на ось концентраций. На данной диаграмме вертикалью составов является перпендикуляр kl, которому соответствует следующий состав: 52 % (масс.) SiO2и 48 % (масс.) TiO2. Прямые bf, gh - это изотермы, соответствующие температурам 1650 °C, 1550 °C соответственно [2].
Кривые ликвидуса показывают состав жидкой фазы насыщенной при соответствующей температуре по отношению к одной твердой кристаллической фазе, то есть существующей с ней в равновесии (tA-a,a-c, c-r, c-r, r-q). Точки кривых ликвидуса показывают также температуру начала кристаллизации при его охлаждении или температуру конца плавления твердого вещества при его нагревании [2].
1.2 Общие сведения
Важна для интерпретации реакции SiO2 c TiO2, при керамических процессах.
Изучалась Рикке, Умецу и Какиуши, Богацким [1]. Опыты проводилисьв условиях восстановительной атмосферы, и потому, присутствовал Ti2O3 и Ti3O5. Фазовая диаграмма по Умецу и Какиуши приводится на рис. 1.3, характерно наличие области несмешиваемости двух жидких фаз.

Рисунок 1.3 - Диаграмма состояния системы TiO2 – SiO2 ( по Умецу и Какиуши)
Риккер и Гюммель вопреки всем предыдущим исследователям нашли в системе два ряда твердых растворов (рис 1.4), которые не подтвердились, однако, стало проверочным исследованием де Вриза, Роя и Осборна [1] рис 1.5.
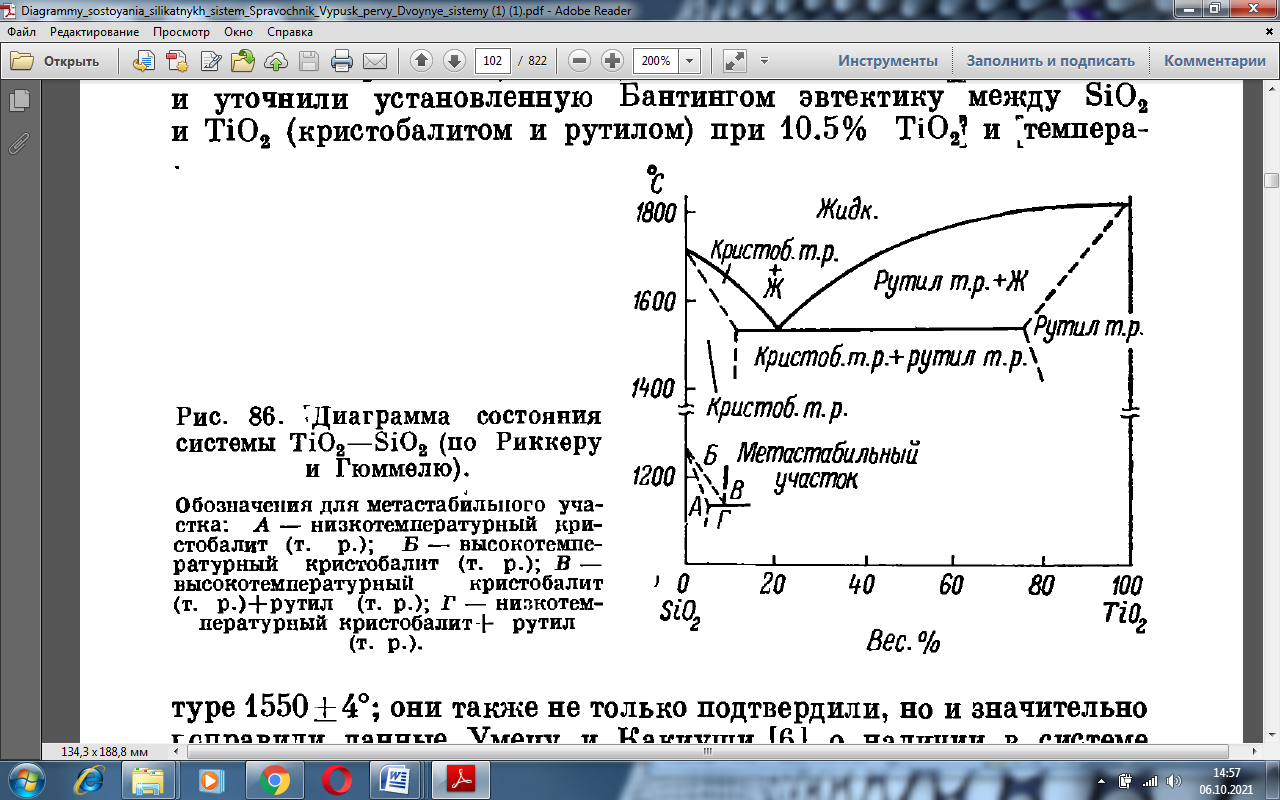
Обозначения для метастабильного участка: А- низкотемпературный кристобалит; Б – высотемпературный кристобалит + рутил; Г – низкотемпературный кристобалит + рутил.
Рисунок 1.4 Диаграмма состояния системы TiO2 – SiO2 (по Риккеру и Гюммелю).
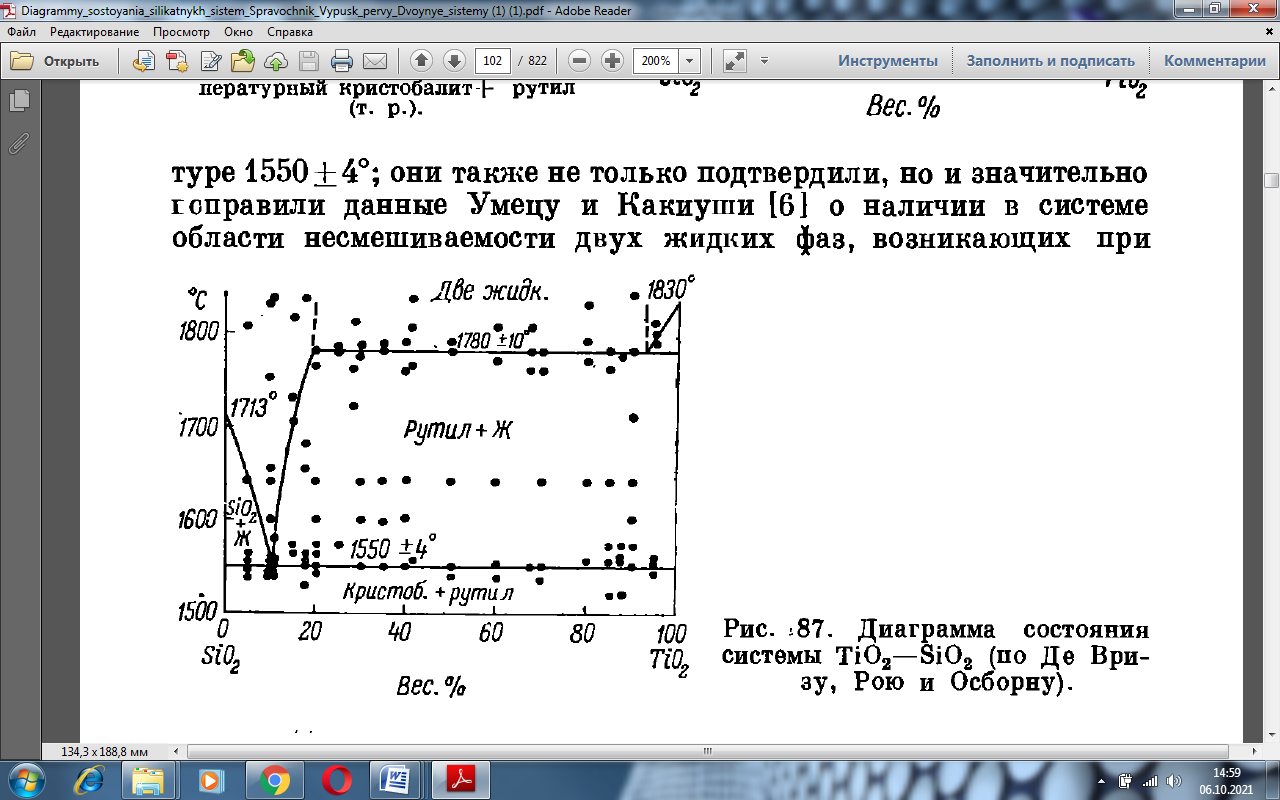
Рисунок 1.5 – Диаграмма состояния системы TiO2 – SiO2 (по Де Вризу, Рою и Осборну).
Последние авторы подтвердили и уточнили установленную Бангтингом (рис 1.6) эвтектику между SiO2 и TiO2 ( кристобалитом и рутилом) при 10.5% TiO2 и температуре 1550 ± 4 °С, они также не только подтвердили, но и значительно поправили данные Умецу и Какиуши о наличии в системе области не смешиваемости двух жидких фаз, возникающих при 1780 ± 10 °С в интервале от 19 до 93% TiO2 [1].
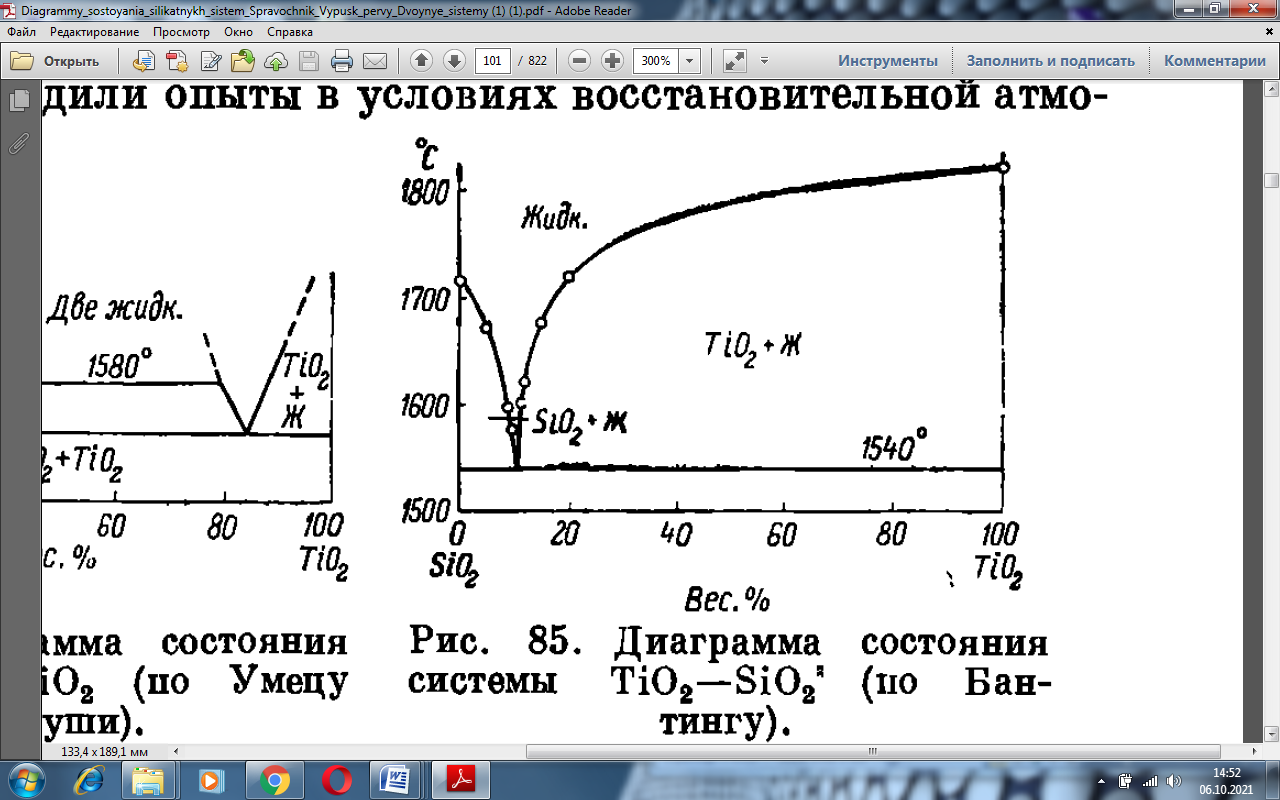
Рисунок 1.6 – Диаграмма состояния системы TiO2 – SiO2 (по Бантингу)
В статье Де Вриза и других [1] приводится на основании их данных и определений Риккера и Гюммеля кривая показателей преломления стекол в зависимости от состава в интервале от 100 ( масс.) % SiO2 – 0% TiO2 до 75% SiO2 – 25% TiO2 ( N – 1.550) – по экспериментальным данным и до 60 % SiO2 – 40% TiO2 (N – 1.600) – по интерполяции.
1.3 Область применения TiO2 – SiO2
В настоящее время активно ведутся исследования, связанные с разработкой методов получения композитных материалов на основе смешанных оксидов, перспективных в качестве прекурсоров керамических сред для лазеров, компонентов стекол с низким коэффициентом линейного термического расширения, катализаторов и фотокатализаторов различных процессов, материалов фотоники. Композиты получают золь-гель методами соосаждения и молекулярного наслаивания в виде порошков, пленок, волокон, материалов со структурой «ядро— оболочка». При использовании композитов SiO2— TiO2 в качестве катализаторов или фотокатализаторов активным компонентом является преимущественно диоксид титана. Установлено, что в некоторых реакциях композит SiO2 — TiO2 проявляет большую каталитическую активность, чем TiO2. Это связано с более развитыми структурно-сорбционными свойствами диоксида кремния и изменением характера кристаллизации в такой системе. Так как каталитические реакции протекают в основном на поверхности катализатора, целесообразно использование структур «ядро—оболочка», где TiO2 в виде наноразмерных частиц распределен на поверхности SiO2. Это позволяет уменьшить количество диоксида титана в композите и, соответственно, снизить стоимость получаемого продукта [3].
2 двухкомпонентная система ZnO – B2O3
2.1 Общая характеристика системы
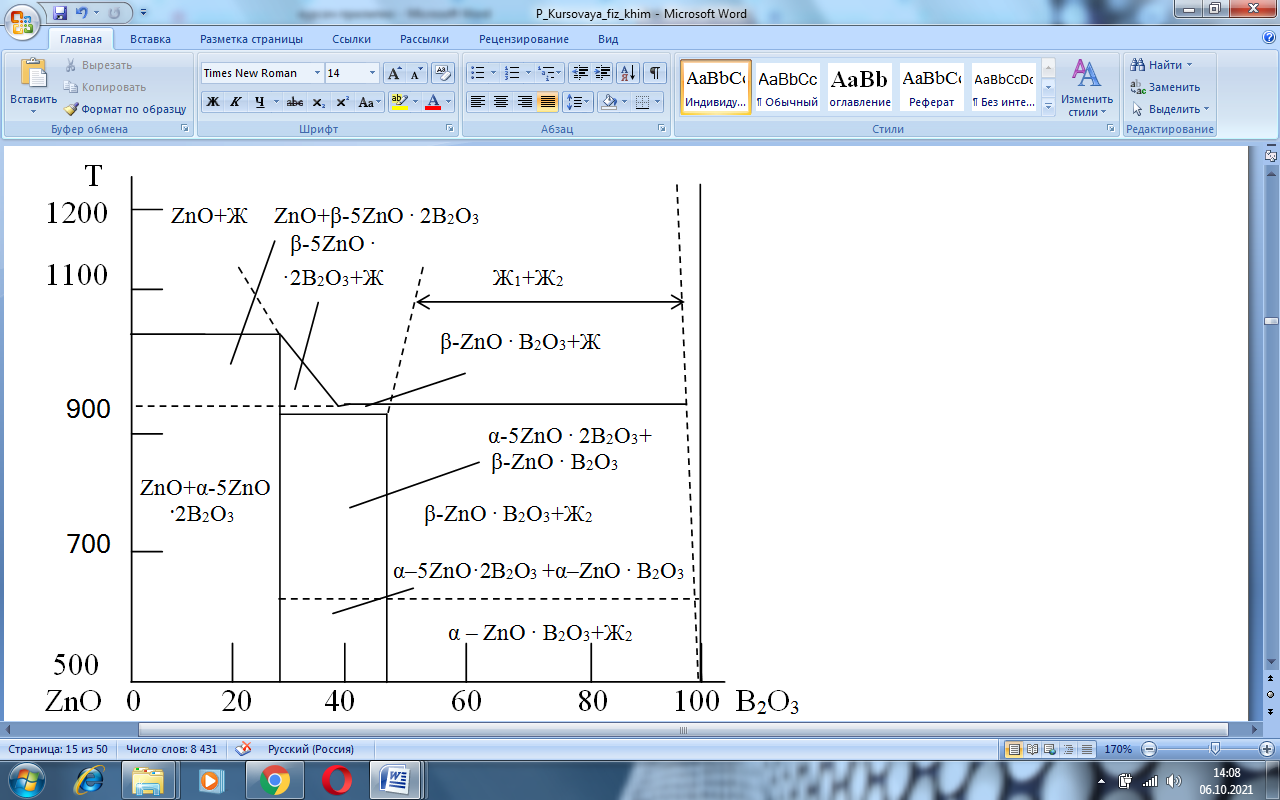
Рисунок 2.1 – Диаграмма состояния системы ZnO – B2O3
Низкотемпературная форма имеет показатели преломления Ng = 1.682, Np = 1,638 она медленно превращается в кубическую додекаэдрическую высокотемпературную форму при 600 °С и очень быстро при 900 °С. Точка ее плавления 982 °С. Показатель преломления N = 1.740 [4].
Низкотемпературная форма 5ZnO – 2B2O3 двуосная, отрицательная (Ng = 1.75, Nm = 1.741, Np = 1.672); по Ингерсону и др, вычисленное (-) 2V = 30 °С, p больше V. Быстрое обратимое превращение α ↔ β 5ZnO – 2B2O3 происходит при 964±4 °С. Инконгруэнтное плавление при 1045 °С.
Эвтектика между 5ZnO – 2B2O3 и ZnO – B2O3 лежит при 961±3 °С и 65,5 вес % ZnO, и ее стекло имеет N = 1.640. Одна из двух жидкостей в области не смешиваемости содержит 53,5 % ZnO и ее стекло имеет N = 1,640.
Светопреломление стекол меняется по прямой от 1,640 при 53,5 вес % ZnO и 46,5 % B2O3 до 1,678 при 68 % ZnO и 32 % B2O3. Линейное расширение ZnO –B2O3 между 50 и 600 °С составляет 35 · 10-7, а для 5ZnO – 2B2O3. – 24,4 · 10-7 Низкотемпературная форма 5ZnO – 2B2O3 c марганцевым активатором дает оранжевую флуоресценцию, а высокотемпературная форма ZnO – B2O3 – зеленую флуоресценцию при 2537. Цинково-боратные стекла и низкотемпературная форма ZnO – B2O3 имеют слабую флуоресценцию [2].
2.2 Элементы строения диаграммы состояния ZnO – B2O3

Рисунок 2.2 – Элементы строения диаграммы состояния ZnO – B2O3
На рисунке 2.2 изображена система ZnO – B2O3, с помощью которой можно рассмотреть основные элементы строения данной диаграммы.
Координатные оси – рассматриваемая диаграмма построена в координатах температура (ось ординат) – концентрация компонентов (ось абсцисс). Цифры на оси абсцисс указывают на содержание компонента в % (масс.). Точки ZnO и B2O3 в начале и в конце оси абсцисс соответствуют 100% содержанию этих компонентов.
Вертикали составов и изотермы – на данной диаграмме вертикалью составов является перпендикуляр kl, которому соответствует следующий состав: 23 % (масс.) ZnO и 78 % (масс.) B2O3. Прямые bf, gh, ae - это изотермы, соответствующие температурам 1045 °C, 964 °C, 962 °C соответственно [2].
Точки составов химических соединений – для диаграммы состояния ZnO – B2O3 характерна низкотемпературная форма 5ZnO – 2B2O3. Состав этого соединения обозначена точкой l, которая соответствует содержанию ZnO и B2O3. Этому соединению соответствует вертикаль состава kl. В зависимости от характера процесса, происходящего при нагревании соединений и возникающих при этом фаз, исследованная диаграмма относится к системе с химическим соединением, которое плавится инконгруэнтно, то есть с разложением. Это означает, что при плавлении образуется жидкость и выделяются кристаллы [2].
Кривые солидуса и ликвидуса–кривые сЕ1, Е1r, rЕ2, Е2d относятся к кривым ликвидуса. Точки этих кривых показывают состав жидкой фазы, насыщенной при температуре по отношению к одной твердой кристаллической фазе, то есть существующей с ней в равновесии. На кривой cЕ1 – в равновесии с жидкой фазой находятся кристаллы соединение ZnO + Ж, на кривой Е1r – начнут выделятся кристалы соединения β-ZnO·2B2O3, на кривой rЕ2 - кристалы соединения β-ZnO·2B2O3, на кривой Е2d – две жидкости Ж1 и Ж2. Точки кривых ликвидуса показывают также температуру начала кристаллизации расплава при его охлаждении или температуру конца плавления твердого вещества при его нагревании [2].
Кривая солидуса представлена ломаной линией bf, fg, gr, re . Точки кривых солидуса показывают состав твердой фазы, в частности насыщенного твердого раствора, находящегося в равновесии с жидкой фазой, а также температуру начала плавления твердой фазы при ее нагревании или конце кристаллизации при охлаждении расплава.
Точки эвтектики – точки в которых пересекаются ветви кривых ликвидуса называются точками эвтектики. Такой точкой на диаграмме являются точка r. Эвтектический состав в этой точке постоянный для данной отдельной системы. В точке эвтектики r находятся следующие фазы 5ZnO – 2B2O3 и ZnO – B2O3 . Плавление или кристаллизация в точке r происходит при постоянной температуре, равной 961 °C. Состав – 53,5 % ZnO, 46,5% B2O3 [2].
Конноды – конноды на диаграммах состояния являются отрезками прямых, которые соединяют своими концами точки составов фаз, находящихся в равновесии при данной температуре. Для системы ZnO – B2O3 коннодами есть отрезки bf, gh, ae. Они параллельны оси концентрации и совпадают с изотермами. Коннода bf лежит своими концами на вертикалях состава соединений ZnO + α-5ZnO·2B2O3, и показывает, что в равновесии находятся фазы, состав которых выражается точками b и f. Коннода gh лежит своими концами на вертикалях состава соединений α-5ZnO·2B2O3 + β-ZnO·B2O3. Коннода ae β-ZnO·2B2O3 + Ж.
2.3 Правила работы с диаграммой ZnO – B2O3
2.3.1 Определения содержания компонентов в исходном составе и в конечных фазах кристаллизации
Для определения концентрации компонентов в жидкой фазе или их содержание в твердом веществе данного состава в двухкомпонентных диаграммах состояния необходимо из фигуративной точки, которая выражает этот состав, опустить на ось концентраций вертикаль состава и отсчитать по этой оси содержание компонентовc.
Например (рис.2.3), содержание компонентов в жидкой фазе состава точки m определится точкой n на оси концентраций (вертикаль состава mn), то есть 70% B2O3 и 30% ZnO [2].
Конечными фазами кристаллизации являются те кристаллические фазы (соединения), между точками составов которых попадает указана вертикаль состава. Следовательно конечными фазами кристаллизации состава m будут соединения α – ZnO · B2O3+Ж2, так как вертикаль состава mn попадает на оси концентраций между точками составов этих соединений.
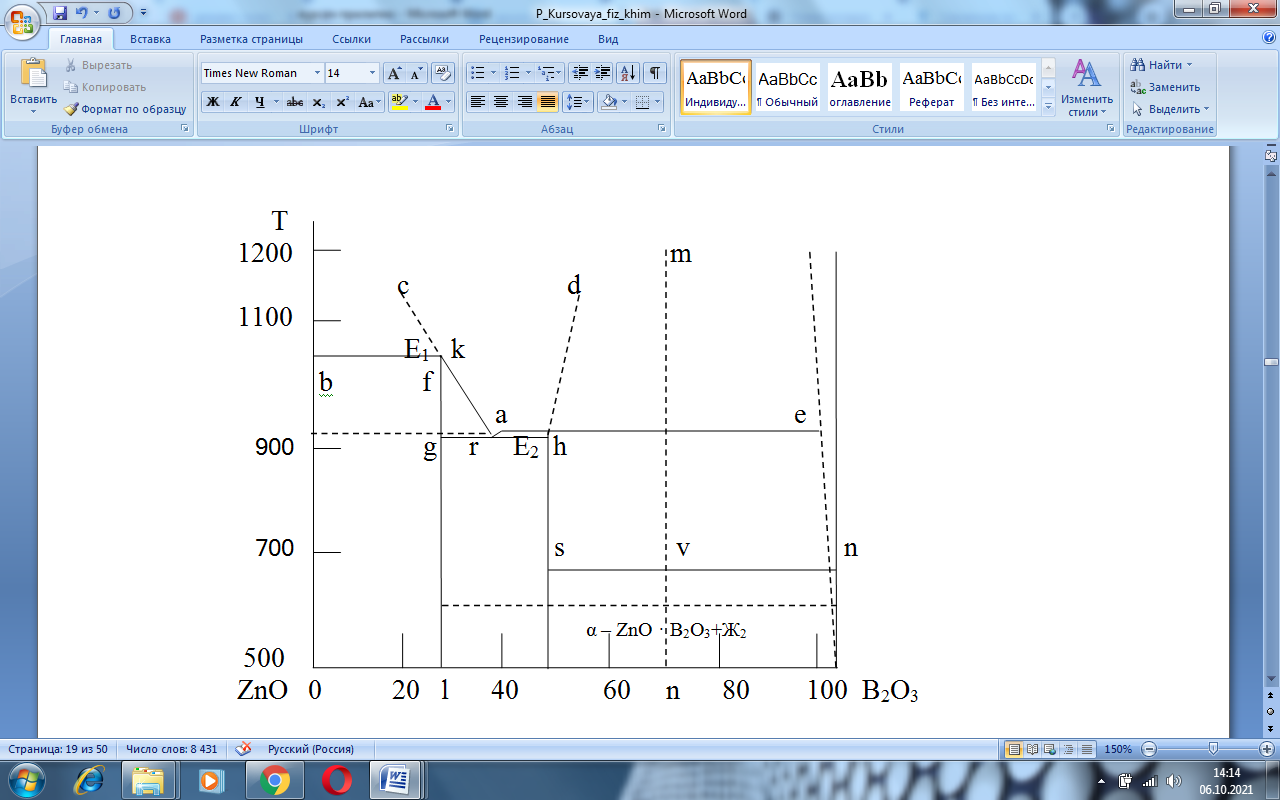
Рисунок 2.3 – Правила работы с диаграммой ZnO – B2O3
2.4 Практическое применение в промышленности
Диаграмма состояния ZnO – B2O3 играет немало важную роль в производстве оптического стекла. Благодаря знаниям в области двухкомпонентной системе ZnO – B2O3, можно определить температуры плавления и стеклообразования. Вообще оксид бора выступает, как один из важнейших оксидов в производстве оптического и других видов стекла. Сам оксид очень гигроскопический и очень тяжело кристаллизуется. Стеклообразный борный ангидрид получают путем простого плавления больной кислоты при температуре 1200 – 1300 °C в вакууме выше 500 °C. Кристаллизация в виде безводных кристаллов B2O3 происходит только при повышенном давлении. Благодаря отменным электроизоляционным качествам и уравновешенной легкоплавкости боратное стекло широко применяется в электротехнике [4].

Рисунок 2.4 – Боратное стекло
Боратное стекло более перспективнее, так как отличается низкой электропроводностью и малыми диэлектрическими утратами, высокой механической прочностью, а также термический и климатической стойкостью. Боратное стекло имеет структуру, отличительную от структуры силикатного стекла, и способное выдерживать спокойные концентрации катионов не увеличивая электропроводность. Боратное стекло состоит из бората цинка, оксида кадмия, оксида алюминия, оксида кремния. Кроме того, они могут включать оксид бериллия и в небольших количествах оксид титана, циркония, ниобия, лантана, церия, скандия, гафния, галия, индия и их смеси. Эти составы стойкие к клонированию в широком диапазоне температур и владеют полным смешиванием составных частей [4].
Благодаря отменным электроизоляционным качествам и уравновешенной легкоплавкости боратное стекло широко применяется в электротехнике. Некоторые виды боратного стекла представляют интерес для оптотехнике [5].
3 Трехкомпонентная система MgO – Al2O3 – SiO2
Современный вид трехкомпонентной диаграммы состояния MgO – Al2O3 –SiO2, предложенный Э. Осборном и А. Муан на основании обобщения опытных данных этой системы представлен на (рис. 3.1).
Система кроме уже рассмотренных бинарных соединений - силикатов магния (2MgO – SiO2, MgO – SO2) и алюминия (3Al2O3 – 2SiO2) существует еще одно бинарное соединение - магнезиальная или благородная шпинель MgO – Al2O3, имеет важное значение в технологии керамики и огнеупоров. Шпинель плавится конгруэнтно при 2135 °С [6].
B некоторых работах было установлено, что именно шпинель является первичным продуктом твердо фазных реакций в системе MgO – Al2O3 – SiO2 при различном соотношении начальных оксидов, объясняется наибольшей скоростью ее образования.
Тройные соединения в этой системе представлены кордиеритом 2MgO – 2Al2O3 – 5SiO2 и сапфирином 4MgO – 5Al2O3 – 2SiO2.
Кордиерит, соединение, плавится инконгруентно при температуре 1540 °С, разлагаясь на жидкость и кристаллы муллита. Кордиерит отличается сложным и до конца не изученным полиморфизмом, образуя несколько полиморфных форм и промежуточных фаз, кроме того, для него характерно образование областей однородности (твердых растворов). Иногда все эти разновидности называют кордиеритно подобными фазами. Приводятся данные о существовании кордиеритно подобных фаз. Рассмотрим подробно некоторые из этих фаз [6].
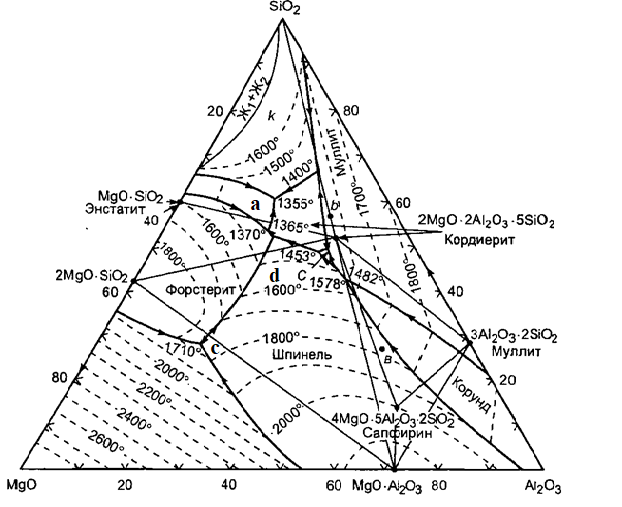
Рисунок 3.1 – Диаграмма состояния системы MgO – Al2O3 – SiO2
3.1 Общая характеристика системы
Первый из представителей кордиеритовои фазы является высокотемпературный гексагональный α- кордиерит (индиалитова фаза - по названию структурно похожего с искусственным α- кордиериты природным минералом индиалитом, что состав кордиерита), α- кордиериты является неурегулированной фазой в структуре которой Al3+, замещает Si4+ в тетраэдрических группах, распределенный статистически. α- кордиериты образуется при высокотемпературной (1000…1300 ºC) быстрой кристаллизации стекла состава кордиеритного или близкого к нему и рассматривается как метастабильное кордиеритно подобная фаза, поскольку при термообработке в широком интервале температур через серию промежуточных соединений превращается в β- кордиерит [6].
Следующая фаза это низкотемпературный ромбический β- кордиерит - упорядоченный и в широком интервале температур стабильна модификацией, чем α- кордиерит. Получается при длительной кристаллизации стекол ниже 950 оС. Стабилен до температуры солидуса. В присутствии жидкой фазы переходит в a-кордиерит. Плотность – 2,507 . 103 кг/м3 [6]
Следующая фаза, лежит в области метастабильного состояния является осумилитовая гексагональная фаза (имеет сходство с минералом осумилитом) представляет собой кордиерито подобную метастабильную фазу, образуется при кристаллизации стекла, в котором содержится несколько больше кремнезема, чем в кордиериты.
Петалитовая фаза – кордиерито подобной метастабильное разновидность, которая образуется при кристаллизации стекла, богатых оксидами магния и кремния. Рассмотрим еще одну из фаз которая является неустойчивой кордиеритовою фазой с переменным составом от 2: 2 : 5 до 1 : 1 : 3 (MgO : Al2O3 : SiO2), восточная по структуре с сподуменом Li2O·Al2O3·4SiO2 - это μ- кордиерит. Кордиениритовые фазы могут существовать в виде твердых растворов. По некоторым данным, изоморфные замещения в кордиериты могут происходить, в результате таких замещений могут возникать кордиерито подобные твердые растворы с избытком или недостатком кремнезема или глинозема. Авторы отмечают склонность соединений рассматриваемой системы к образованию твердых растворов, которые, например, были обнаружены в частных системах 2MgO·2Al2O3·5SiO2 – MgO·SiO2, MgO·Al2O3 – 2MgO·SiO2, MgO – 2MgO·SiO2. Метастабильные кварцево подобные твердые растворы со структурой высокотемпературного α- кварца найдены между SiO2  MgO·Al2O3.
MgO·Al2O3.
Фазовые соотношения между различными разновидностями кордиерита усложняются образованием промежуточных фаз с разной степенью упорядоченности. Температурные области стабильного или метастабильного существования отдельных кордиерито подобных фаз могут меняться в зависимости от их состава. H. А. Toропов [1] установил, что гексагональный α- кордиерит после длительной выдержки при температуре 1400 ºC переходит в ромбический β- кордиерит, устойчивый до 1440 °С. При 1460 ºC происходит обратный переход β- кордиерита в высокотемпературную α- форму. Кристаллическая структура кордиерита образована шестичленными кольцами из тетраэдров [SiО4] и [AlO4], соединенных вершинами. Кольца связываются двумя общими атомами кислорода, между которыми образуется большой полый канал. Такие колонны колец соединяются четырехкоординированными ионами алюминия и шестикоординированными ионами магния [1].
Вторым обозначенным на диаграмме состояния системы MgO – Al2O3 – SiO2 тройной соединением является сапфиpин 4MgO – 5Al2O3 – 2SiO2. Это соединение плавится инконгруентно при 1475 °С, разлагаясь на жидкость и шпинель. Известно и еще несколько алюмосиликатов магния, хотя ни один из них не может при нормальном давлении существовать стабильно в контакте с расплавами этой системы. K таким соединениям относятся, в частности, пироп, что встречается в природе в виде 3MgO – Al2O3 – 3SiO2,относящийся к группе гранатов. Пироп был синтезирован при повышенном давлении - (6 ÷ 12) · 103 МПа и температуре 1500 ± 150 °С [6].
Кроме составов для огнеупоров, получаемых на основе форстерита, периклаза, шпинели, корунда и муллита, особое значение имеют составы, близкие к кордиериты, на основе которых получают кордиеритовую керамику. Для промышленного изготовления кордиеритовой керамики используют природные материалы: тальк, высококачественные огнеупорные глины и технический глинозем. Температура обжига – 1300 – 1410 °С. В кордиеритовой керамике содержится около 80% кордиерита, а также муллит, клиноенстатит, корунд и стекло. Из двойных соединений области кристаллизации в системе образуют: протоэнстатит MgO – SiO2, форстерит 2MgO – 2SiO2 и шпинель MgO – Al2O3. Кроме того, имеются поля кристаллизации SiO2, Al2O3 и MgO. В поле кристаллизации кристобалита есть область стабильной ликвации [2].
3.2 Элементы строения диаграммы состояния MgO – Al2O3 – SiO2
Треугольник концентраций – диаграмма трехкомпонентной системы MgO – Al2O3 – SiO2 представлена на (рисунке 3.1). Треугольник составов (концентраций) является основой трехкомпонентных диаграмм состояния, на сторонах которых откладывается содержание компонентов в массовых процентах. В данном случае этими компонентами являются: Al2O3, SiO2, MgO. Вершины треугольника соответствуют чистым компонентам, то есть стопроцентному содержанию того компонента, обозначения которого стоит у данного угла треугольника, а два других угла соответствуют нулевому содержанию этого компонента. Отсчет содержания данного компонента ведется по любой из двух сторон треугольника, образующих угол с обозначением этого компонента, в направлении от угла с его нулевым содержанием [2].
Например, в данной системе отсчет содержания компонента MgO будет вестись от угла со стопроцентным содержанием компонента Al2O3 вправо к углу со стопроцентным содержанием данного компонента - MgO.
Точки составов двойных (бинарных) соединений, образуемых двумя какими-либо компонентами системы, располагаются на сторонах треугольника концентраций, а точки составов тройных соединений, образуемых тремя компонентами системы, находятся внутри треугольника концентраций.
Изотермы – температура на плоскостной температурной диаграмме изображена в виде линий равных температур – изотерм, расположенных через 100оС с обозначением температуры, соответствующей данной изотерме. Например, в поле первичной кристаллизации шпинели можно обнаружить изотермы, соответствующие температурам: 1800 оС и 2000 оС; в поле первичной кристаллизации муллита можно обнаружить изотермы, соответствующие температурам 1800 оС и 1700 оС.
Инвариантные точки и поля первичной кристаллизации – наиболее легкоплавкая эвтектика с температурой 1355 оС образована протоэнстатитом, кордиеритом и кремнеземом.
Система характеризуется большой склонностью к образованию твердых растворов. У. Шрейер указывает на возможность изоморфных замещений в кордиерите по двум схемам [2]:
Mg2+ + Si4+ « 2Al3+ и 2Al3+ + Mg2+ « 2Si4+.
В результате таких замещений могут возникнуть четыре вида кордиеритовых твердых растворов:
1) кордиерит, пересыщенный кремнеземом, т.е. с избытком кремнезема;
2) кордиерит с недостатком кремнезема;
3) кордиерит с избытком глинозема;
4) кордиерит с недостатком глинозема [2].
В частной системе MgO – Al2O3 – SiO2 обнаружены метастабильные твердые растворы со структурой высокотемпературного кварца. Этот разрез имеет особое значение, так как в него входит кордиерит. К твердым растворам шпинели MgO . Al2O3 в кварце относят кремнезем – О, а также m- кордиерит. Тепловое расширение кварцеподобных твердых растворов в системе MgO – Al2O3 – SiO2 мало. Выше 1300 оС метастабильные кварцевые твердые растворы быстро и необратимо переходят в равновесные фазы [6].
Пути кристаллизации в системе отличаются значительной сложностью вследствие инконгруэнтного характера плавления тройных соединений. Наибольший интерес представляют пути кристаллизации составов, лежащих в области кордиерита или вблизи него (керамические и ситалловые составы), а также в областях шпинели, корунда и муллита (огнеупоры).
В поле кордиерита пути кристаллизации идут по прямым, исходящим из точки состава 2:2:5 (кордиерит). Заканчивается кристаллизация в эвтектических точках с температурой 1355 оС, если точка заданного состава лежит в фазовом треугольнике кордиерит-протоэнстатит-тридимит, и 1365 оС – в случае фазового треугольника кордиерит – протоэнстатит – форстерит. только незначительная часть составов этой области, принадлежащих фазовому треугольнику кордиерит –форстерит – шпинель, заканчивает кристаллизацию в точке двойного подъема с температурой 1370 оС.
Составы, лежащие в поле кристаллизации муллита или шпинели, имеют более сложные пути кристаллизации. Пограничные кривые между полями кристаллизации сапфирина – шпинели и муллита – кордиерита инконгруэнтны, а инвариантная точка с температурой 1482 оС между полями шпинели, муллита и сапфирина является точкой двойного опускания. Поэтому пути кристаллизации расплавов могут проходить две тройные инвариантные точки и заканчиваться в третьей. Так, состав а, который относится к фазовому треугольнику сапфирин – муллит-кордиерит, будет иметь путь кристаллизации, проходящий через точку двойного подъема с температурой 1578 оС (шпинель – муллит – корунд), а затем через точку двойного опускания с температурой 1482 оС (шпинель – муллит – сапфирин) и заканчивающийся в точке двойного подъема с температурой 1460 оС (сапфирин – муллит – кордиерит). В точке двойного опускания (1482оС) закончат кристаллизацию лишь составы, лежащие в фазовом треугольнике шпинель – сапфирин – муллит [6].
Состав b лежит в поле кристаллизации муллита. Путь кристаллизации его пойдет по продолжению линии «муллит – точка b» с выделением муллита. Далее фазовые превращения пойдут по схеме: расплав ® муллит + жидкость ® муллит (растворяется) + кордиерит (образуется) + жидкость ® кордиерит + жидкость ® кордиерит + тридимит + жидкость ® (в точке эвтектики): кордиерит + тридимит + протоэнстатит + жидкость ® кордиерит + тридимит + протоэнстатит. Кристаллизация закончится в эвтектике при температуре 1355 оС. Таким образом, кристаллы муллита на пограничной кривой растворяются и путь кристаллизации покинет пограничную кривую в точке исчезновения кристаллов муллита [2].
Более внимательный анализ высокоглиноземистой части системы MgO – Al2O3 – SiO2 приводит к некоторым сомнениям относительно хода пограничных кривых, ограничивающих поле корунда. Дело в том, что три конгруэнтно плавящихся соединения – Al2O3, MgO . Al2O3 и 3Al2O3 . 2SiO2 – должны давать между собой эвтектику.
Таблица 3.1. Инвариантные точки системы MgO – Al2O3 – SiO2
| № | Сосуществующие фазы | Процесс | Температура, оС |
| 1. | MgO . SiO2 + SiO2 + 2:2:5 + жидкость | эвтектика | |
| 2. | MgO . SiO2 +2MgO . SiO2 + 2:2:5 + жидкость | эвтектика | |
| 3. | 2MgO . SiO2 +MgO . Al2O3 + 2:2:5 + жидкость | точка двойного подъема | |
| 4. | MgO + 2MgO . SiO2 + MgO . Al2O3 + жидкость | эвтектика | |
| 5. | MgO . Al2O3 + Al2O3 + 3Al2O3 . 2SiO2 + жидкость | точка двойного подъема | |
| 6. | MgO . Al2O3 + 3Al2O3 . 2SiO2 + 4:5:2 + жидкость | точка двойного опускания | |
| 7. | 3Al2O3 . 2SiO2 + 4:5:2 + 2:2:5 + жидкость | точка двойного подъема | |
| 8. | MgO . Al2O3 + 4:5:2 + 2:2:5 + жидкость | точка двойного подъема | |
| 9. | 2:2:5 + 3Al2O3 . 2SiO2 + жидкость | инконгруэнтное плавление | |
| 4:5:2 + MgO . Al2O3 + жидкость | инконгруэнтное плавление |
Тройные точки – образуют три сходящиеся кривые на диаграмме состояния. В этих точках в равновесии находятся четыре фазы: жидкость состава этой точки и три кристаллических соединения, поля первичной кристаллизации которых сходятся в этой точке. Это условие соблюдается, если кристаллизация не закончена.
В зависимости от направления падения температуры на пограничных кривых, тройные точки делятся на точки эвтектики, точки двойного подъема ы и точки двойного опускания [2].
Точка эвтектики является точкой, образованной тремя пограничными кривыми с температурой, падающей по всем трем направлениям кривых к этой точке. Например точками эвтектики в системе MgO – Al2O3 – SiO2 являются точки обозначенные на рисунке 3.1, как точки а и с.
Точка двойного подъема образована тремя пограничными кривыми, по двум из которых температура падает к точке, а по одной от точки. Точкой двойного подъема в системе MgO–Al2O3–SiO2 является точка d.
Точка двойного опускания образуется, когда по одной пограничной кривой температура падает к точке, а по двум другим пограничным кривым падает от точки.
Наиболее легкоплавкая эвтектика в системе имеет температуру 1355 оС и образована протоэнстатитом, кордиеритом и кремнеземом [2].
3.3 Применение правила рычага в трехкомпонентных системах
В трехкомпонентной диаграмме состояния возможны три типа задач с использованием правила рычага – определение количественного содержания фаз образовавшихся за весь путь кристаллизации при наличии в системе:
1 жидкой и одной твердой фазы;
2 жидкой и двух твердых фаз;
3 определение количественного соотношения твердых фаз, выделяющихся из расплава в данный момент кристаллизации.
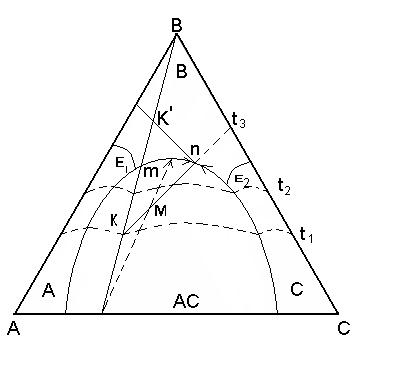
Рисунок 3.2 – Правило рычага в трехкомпонентной системе
1. Точка состава жидкой фазы находится в поле первичной кристаллизации какого – либо соединения. Пусть состав расплава М охлажден до температуры t2 при этом температура в равновесии будет находится жидкая фаза состава m и кристаллы АС выделившиеся в процессе охлаждения исходного расплава. В соответствии с правилом рычага содержание фаз за весь путь кристаллизации от t1 – t2 определяется из выражения:
Содержание жидкой фазы:
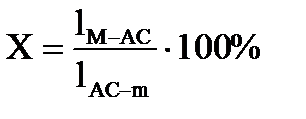
Содержание кристаллов АС:
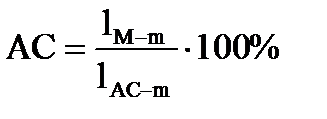
2. Точка состава жидкой фазы находится на пограничной кривой. Путь кристаллизации того же расплава состава М продолжается до температуры t3. При этой температуре в равновесии находится три фазы: жидкое состава точки n, лежащей на пограничной кривой и две твердые фазы – это кристаллы В и АС. Определяется путь кристаллизации от температуры t1 – t3 . Сначала определяется содержание жидкой и всей твердой фаз, суммарное содержание В + АС, а затем содержание В и АС в отдельности:
Содержание жидкой фазы:
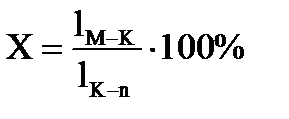
Содержание АС+В:
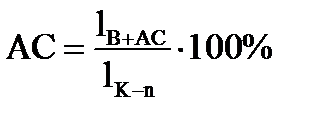
Содержание АС в твердой
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|