
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Качественный анализ
Качественный анализ
Для получения достоверных результатов анализа конкретного иона необходимы реакции, выполнению которых не мешает присутствие других ионов. Для этого нужны специфические реагенты (взаимодействующие только с определяемым ионом).
Примером реакции с участием специфического реагента является выделение газообразного аммиака NH 3 при действии щелочей (KOH или NaOH) на вещество, содержащее ион аммония NH4 +. Ни один катион не помешает обнаружению иона NH4+, потому что только он реагирует со щелочами с выделением аммиака:
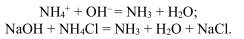
. Еще один пример — специфические реагенты на ионы железа. Специфический реактив гексацианоферрат (III) калия К3[Fе(СN)6] (красная кровяная соль) образует синий осадок (турнбуллева синь) только с ионами двухвалентного железа Fe 2+. Гексацианоферрат (II) калия K4[Fe(CN)6] (желтая кровяная соль) образует синий осадок (берлинская лазурь) только с ионами трехвалентного железа Fe3+. Специфический реагент на ионы меди (II) — аммиак:
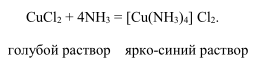
Окрашивание пламени горелки является также способом определения некоторых катионов, т. е. качественной реакцией на их присутствие:
Li + — окрашивание пламени в красный цвет;
Na + — окрашивание пламени в желтый цвет;
K + — окрашивание пламени в фиолетовый цвет.
Селективные реагенты — это реагенты, которые реагируют лишь с немногими веществами. Диметилглиоксим (реагент Чугаева) служит примером селективного реагента в щелочной среде он реагирует с ионами Ni +2, Co +2, Fe +2; в кислой — только с ионами Pd +2.
К сожалению, селективных, а тем более специфических реагентов очень мало. Поэтому смеси катионов и анионов разделяют на части с помощью реактива, который называется групповым реактивом.
Действуя на смесь катионов в строго определенном порядке растворами соляной кислоты HCl, серной кислоты H2SO4, аммиака NH3 и гидроксида натрия NaOH, можно разделить содержащиеся в смеси катионы на шесть аналитических групп. Эти растворы называются групповыми реагентами, а схема — кислотно-щелочной (по используемым групповым реагентам).
В сероводородной схеме групповыми реагентами являются соляная кислота HCl, сероводород H2S и карбонат аммония (NH4)2CO3.
Разделение катионов на пять аналитических групп основано на различии свойств образуемых ими хлоридов, сульфидов и карбонатов:
- I группа K +, Na +, NH +4, Mg +2 — группового реагента нет, поэтому эти катионы остаются в растворе после отделения других групп;
- II группа Ba +2, Ca +2, Sr +2 — групповой реагент (NH4) 2 CO 3 осаждает карбонаты этих катионов;
- III группа Al +3, Cr +3, Fe +3, Fe +2, Ni +2, Co +2, Mn +2, Zn +2 — групповой реагент (NH4) 2 S осаждает гидроксиды Al +3 и Cr +3 и сульфиды остальных катионов;
- IV группа Cu +2, Cd +2, Hg +2, Bi +3, As +3, Sn +2, Sn +4, Sb +2 — групповой реагент H 2 S осаждает сульфиды этих катионов;
- V группа Ag +, Pb +2 и Hg +2 — групповой реагент HCl — осаждает хлориды этих катионов.
Общепринятой классификации для разделения анионов, как для разделения катионов, не существует. Используют разделение анионов на три аналитические группы по растворимости солей бария и серебра.
- ● Первая группа сульфат-ион SO 4 –2, сульфит-ион SO 3 –2, тиосульфат-ион S 2 O 3 –2 , карбонат-ион CO 3 –2, фосфат-ион PO 4 –3, силикатион SiO 3 –2, борат-ионы BO 2 – или B 4 O 7 –2.
Групповой реагент — ВаСl2 в нейтральной или слабощелочной среде. Соли бария малорастворимы в воде, но растворяются в разбавленных кислотах (за исключением BaSO4).
Например, важнейшими промышленными солями бария являются хлорид, карбонат и сульфат. Технический продукт содержит 80−90 % ВаО2 и окрашен соединениями железа в желтоватый или зеленоватый цвет. Зеленая окраска пламени — «визитная карточка» бария, даже если он присутствует в микроколичествах.
Барий присутствует в крови, мышцах, головном мозге, селезенке и даже в хрусталике глаза. Опасность для человека несут водорастворимые соли бария, а именно карбонаты, сульфиды, нитраты.
Всасывание растворимых солей бария в желудочно-кишечном тракте составляет около 10 %, иногда этот показатель доходит до 30 %. Гомеопаты рекомендуют принимать углекислый барий пожилым людям, страдающим ожирением, когда присутствуют симптомы склероза. - ● Вторая группа хлорид-ион Cl –, бромид-ион Br –, йодид-ион I –, сульфид-ион S –2 и др. Серебряные соли малорастворимы в воде и в HNO3.
Групповой реагент — AgNO3 в присутствии HNO3.
Например, сульфид-ион — хороший восстановитель и окисляется большинством известных окислителей, даже кислородом воздуха. Реакция восстановления бромат-ионов бромид-ионами или йодид-ионами протекает в кислой среде.
Йодид-ионы окисляются гораздо легче, чем хлорид- или бромидионы. Хлорид-ион обесцвечивает перманганат калия при нагревании. В присутствии сульфид-ионов появляется осадок свободной серы.
Основным источником хлорид-ионов является поваренная соль, используемая при приготовлении пищевых продуктов. Хлориды обладают высокой миграционной способностью благодаря хорошей растворимости. У животных и человека ионы хлора участвуют в поддержании осмотического равновесия. - ● Третья группа нитрат-ион (NO3) – , нитрит-ион (NO2) – и др. Соли бария и серебра растворимы в воде. Группового реагента нет.
В отличие от катионов, анионы обычно не мешают обнаружению друг друга. Систематический анализ используют в редких случаях.
Например, широко известно также применение нитритов для консервирования пищевых продуктов. Предельно допустимая концентрация нитритов в воде водоемов (ПДКв) установлена в размере 3,3 мгдм 3 в виде иона (NO2) –.
Методы качественного анализа классифицируют следующим образом:
— анализ катионов;
— анализ анионов;
— анализ сложных смесей.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|