
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Тема 10. Основные положения молекулярно – кинетической теории.
Тема 10. Основные положения молекулярно – кинетической теории.
1. Все тела состоят из веществ. Опытным путем было установлено, что любое вещество состоит из молекул. Молекула – мельчайшая частица вещества, проявляющая химические свойства данного вещества. Молекулы состоят из атомов. Атомы химических свойств вещества могут и не проявлять. Например, молекула воды Н2О состоит из двух атомов водорода и одного атома кислорода.
Атомы – мельчайшие частицы химических элементов. Систематизация атомов была проведена выдающимся русским ученым Д.И. Менделеевым. Он создал периодическую таблицу элементов. Каждый элемент имеет свое название и символ. В периодической таблице около символа пишется его порядковый номер, атомная масса, которую часто округляют до целых и называют массовым числом.
1 атомная единица массы = 1,66*10-27 кг.
Размеры атомов очень малы, их диаметр порядка 2,6*10-10 м. Современные микроскопы позволяют различать отдельные молекулы, и даже атомы.
Часто в физике и химии используется понятие молярной массы. В одном моле любого вещества, как показал французский физик Авогадро, содержится одинаковое количество молекул, которое называется числом Авогадро:
NA = 6*1023 1/моль = 6*1026 1/кмоль.
Так для кислорода М = 32 г/моль, для воды М = 18 г/моль, для углекислого газа М = 44г/моль.
Число молекул в единице объема называют концентрацией молекул 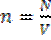 , где N – число молекул, а V – объем вещества.
, где N – число молекул, а V – объем вещества.
Масса одной молекулы вещества 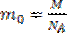
Если известна масса вещества, то легко найти число молекул этого вещества:
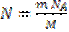 , где
, где 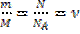 называют количеством вещества.
называют количеством вещества.
2. Молекулы в телах располагаются на некотором расстоянии друг от друга. У твердых тел и у жидкостей эти расстояния невелики по сравнению с диаметром самой молекулы. У газов межмолекулярные расстояния могут быть любыми. О наличии промежутков между молекулами говорят такие факты, как изменение объема тела при изменении температуры; изменение объема тела под действием внешних нагрузок; диффузия.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|