
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Донорно-акцепторное взаимодействие
6. Донорно-акцепторное взаимодействие
Если одна из двух молекул имеет атом со свободными орбиталями, а другая - атом с парой неподелённых электронов, то между ними происходит донорно-акцепторное взаимодействие, которое приводит к образованию ковалентной связи, например:
NH3 + BF3 = NH3BF3
У атома азота в молекуле аммиака имеется неподеленная пара электронов, а у атома бора в молекуле трифторида бора - вакантная орбиталь.
При взаимодействии по донорно - акцепторному механизму атом азота отдает на связь пару электронов, а атом бора - вакантную орбиталь, в результате чего возникает ковалентная связь:
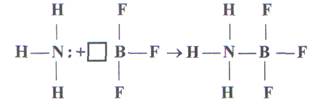
донор акцептор
Аналогичным образом образуется комплексное соединение при взаимодействии сульфата меди и аммиака:
CuSO4 + 4NH3 = [Cu (NH3)4] SO4
7. Водородная связь.
Водородная связь осуществляется между поляризованным водородом одной молекулы и каким-то электроотрицательным атомом или группой атомов другой или одной и той же молекулы (например, кислородом, гидроксогруппой, фтором, азотом, карбоксильной группой, реже хлором, серой и др.):
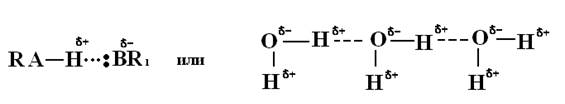
С одним из атомов (А) водород обычно связан значительно сильнее (за счет ковалентной связи), чем с другим (В). Последняя связь получила название водородной.Ее обычно изображают точками или пунктиром.
Водородная связь - это промежуточный случай между ван-дер-ваальсовым взаимодействием и ковалентной связью. Она по прочности превосходит ван-дер-ваальсово взаимодействие, и ее энергия составляет 8 - 40 кДж/моль. Однако она обычно на порядок слабее ковалентной связи.
Например, в твердом, жидком и даже в газовом состоянии молекулы фторида водорода НF ассоциированы в зигзагообразные цепочки вида
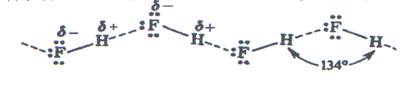
,
что обусловлено водородной связью.
Молекула воды может образовывать четыре водородные связи, так как имеет два атома водорода и две несвязывающие электронные пары:

Эта способность молекулы воды обусловливает строение воды и льда.
КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ.
Значение комплексных соединений для различных областей техники очень велико. Благодаря способности веществ образовывать комплексные соединения разработаны эффективные методы получения химически чистых металлов из руд, редких металлов, сверхчистых полупроводниковых материалов, красителей и т.д. В практике эксплуатации морского флота комплексные соединения используются для организации водно-химических режимов судовых парогенераторов, для эффективной очистки судового энергетического оборудования от накипи, для обессоливания воды, при проведении судовых анализов и т. д.
Комплексные соединения относятся к соединениям высшего порядка, они имеют в своем составе устойчивые, не укладывающиеся в рамки формальной валентности, комплексные ионы, которые обладают специфическими химическими свойствами и во многих химических реакциях переходят из соединения в соединение, не меняясь.
Комплексные ионы образуются донорно-акцепторным способом за счет присоединения комплексообразователем определенного числа других ионов, молекул или радикалов, именуемых лигандами или аддендами. Комплексообразователями, как правило, являются атомы или ионы металлов, имеющие достаточное число свободных орбиталей.
Лигандами могут служить анионы (Fֿֿ ,OHֿ , CNֿ ,CO₃²ֿ и т.д.) и нейтральные молекулы ( H₂O, NH₃, NO и др).
Количество лигандов в комплексе называется координационным числом комплексообразователя, которое может принимать значения от 2 до 12, что зависит от числа свободных орбиталей комплексообразователя.
Заряд комплексного иона численно равен суммарному заряду комплексообразователя и лигандов.
Условием образования донорно-акцепторной связи является: наличие свободной электронной пары у атома (иона, молекулы, радикала)- донора и свободной орбитали у атома (иона, молекулы)-акцептора. Например, в хлориде диамминосеребра (I) [H₃N:→Ag←:NH₃]Cl две донорно-акцепторные связи обозначенны стрелками, направленными от донора (атом азота в аммиаке) к акцептору (ион серебра).
Комплексные соединения подразделяются на неэлектролиты и электролиты, которые при растворении в воде (или другом растворителе) диссоциируют на ионы и ведут себя как сильные электролиты.
[Ag(NH₃)₂]Cl→[Ag( NH₃)₂]⁺+Cl⁻
Однако, сами комплексные ионы диссоциируют лишь в незначительной степени:
[Ag(NH₃)₂]⁺⇔Ag⁺+2NH₃
Применяя закон действующих масс к процессу диссоциации комплексного иона, можно записать выражение константы нестойкости комплексного иона, которая характеризует способность комплексного иона распадаться на составляющие его частицы.
Например:

Кн= 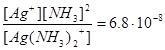
Значения констант нестойкости некоторых комплексных ионов приведены в таблице.
Устойчивость комплексного иона нарушается при понижении концентрации одного из компонентов, входящих в состав комплексного иона в соответствии с принципом Ле-Шателье, характеризующим состояие равновесия в системе. Чаще всего это касается комплексообразователей, которые могут быть связаны в труднорастворимые соли вследствие превышения величины произведения растворимости (ПР) этих солей.
В общем случае, если величина ПР соли меньше величины константы нестойкости комплексного иона, комплексное соединение в растворе будет разрушаться.
Например, при введении в раствор хлорида диамминосеребра (I) ионов OH⁻ комплексный ион не разрушается, так как величина произведения растворимости AgOH и константа нестойкости данного комплексного иона одинаковы и равны:
ПРAgOH =6.8‧10⁻⁸, Кн =6.8 ‧10⁻⁸
При введении же в раствор, например, ионов иода, комплексное соединение разрушится:
[Ag(NH₃)₂]Cl + KI→AgI↓+ 2NH₃+KCl,
так как величина ПРAgI =1.7∙10⁻¹⁶, т.е. в данном случае выполняется условие: ПР<Кн.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|