
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Закон радиоактивного распада
| Физика атома и атомного ядра. | ||||
| Опыты Резерфорда: | Планетарная модель атома: | |||
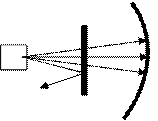 α-частицы
Au
экран α-частицы
Au
экран
 Au
α Au
α
|
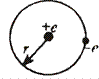
dядра ≈ 10-14 ÷ 10-15 м dатома ≈ 10-10 м
| 
|
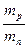 ≈ 1836,1 ≈ 1836,1
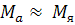
| |
| Постулаты Бора | Теоретическая модель атома водорода | |||
|
1. Постулат стационарных состояний: атомная система может находиться только в особых стационарных, или квантовых, состояниях, каждому из которых соответствует определенная энергия Еп; в стационарном состоянии атом не излучает. 2. Постулат об излучении (поглощении) света: Излучение (поглощение) света происходит при переходе атома из одного стационарного состояния с энергией Ek в другое стационарное состояние с энергией Еп. Энергия излученного (поглощённого) фотона равна разности энергий стационарных состояний. Правило частот: |Ek – En|= hνkn
| ν = R( ионизация атома Еиониз.= Е0 | |||
|
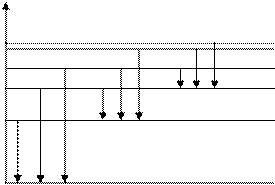
n = ∞ n = 4 n = 3 серия Пашена n= 2 серия Бальмера
n = 1
поглощение hν12 ν12 = ν21 1 излучение 2 hν21 | ||||
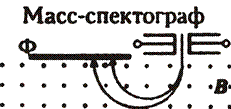
| Методы наблюдения и регистрации заряженных частиц | ||||
| 1. Подсчет сцинтилляций (вспышек): ионизация | 2. Счетчик Гейгера-Мюллера(1908): ударная ионизация | 3. Камера Вильсона (1912): конденсация | 4. Пузырьковая камера (1952): кипение | 5. Метод толстослойных фотоэмульсий (1896): ионизация |
| регистрирует все элементарные частицы и γ-кванты | регистрирует электроны и
γ-кванты

| регистрирует
α-частицы (фиксирует трек)

| регистрирует
α-частицы, протоны, нейтроны
(фиксирует трек)

| регистрирует все частицы |
| Трек – видимый след частицы | ||||
| |||||||||||||
Закон радиоактивного распада
( статистический закон ):
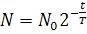
T – период полураспада – это то время, в течение которого распадается примерно половина начального числа радиоактивных атомов.
 N N – число не распавшихся атомов в момент t
N N – число не распавшихся атомов в момент t
N0 - число не распавшихся атомов в момент t0
(N – N0) – распалось атомов
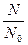 - доля (часть) не распавшихся атомов
- доля (часть) не распавшихся атомов

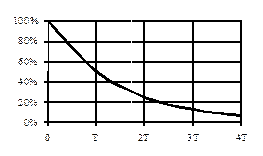 t
t 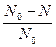 - доля (часть) распавшихся атомов
- доля (часть) распавшихся атомов
Правило смещения:
α – распад:
ZAX →Z-2A-4Y + 24He
На основе законов сохранения массового и зарядового числа
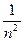 -
- 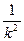 )
) Е
Е серия Лаймана
серия Лаймана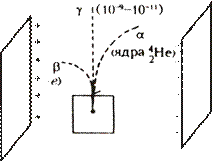
 Изотопы - это атомные ядра с одинаковым зарядом
Изотопы - это атомные ядра с одинаковым зарядом