
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Хлороводород: получение и свойства
Хлороводород: получение и свойства
Хлороводород(Хлористый водород)
Строение:
Молекулярная формула: НCl
Электронная формула:
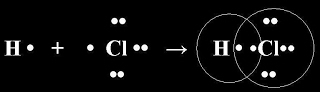 Структурная формула:
Н – Сl
σ (s-p) – связь сигма, ковалентная полярная
Физические свойства
Бесцветный газ с резким запахом, ядовитый, тяжелее воздуха, хорошо растворим в воде (1 : 400). t°пл. = -114°C, t°кип. = -85°С.
Получение
1) Промышленный – сжигание водорода в хлоре (пройдите по ссылке)
H2 + Cl2 t˚C→ 2HCl
2) Лабораторный:
NaCl(тв.) + H2SO4(конц.) t =18-20˚C → NaHSO4 + HCl↑
2NaCl(тв.) + H2SO4(конц.) сильное нагревание → Na2 SO4 + 2HCl↑
Применение хлороводорода:
1) Получение соляной кислоты
2) Получение пластмасс и каучука.
Структурная формула:
Н – Сl
σ (s-p) – связь сигма, ковалентная полярная
Физические свойства
Бесцветный газ с резким запахом, ядовитый, тяжелее воздуха, хорошо растворим в воде (1 : 400). t°пл. = -114°C, t°кип. = -85°С.
Получение
1) Промышленный – сжигание водорода в хлоре (пройдите по ссылке)
H2 + Cl2 t˚C→ 2HCl
2) Лабораторный:
NaCl(тв.) + H2SO4(конц.) t =18-20˚C → NaHSO4 + HCl↑
2NaCl(тв.) + H2SO4(конц.) сильное нагревание → Na2 SO4 + 2HCl↑
Применение хлороводорода:
1) Получение соляной кислоты
2) Получение пластмасс и каучука.
|
Соляная кислота и её соли
| Соляная кислота Физические свойства: Концентрированная соляная кислота – это бесцветный раствор, сильнодымящий во влажном воздухе, с резким запахом. Получение соляной кислоты Химические свойства: Опыт "Свойства дымящей соляной кислоты" Действие соляной кислоты на различные вещества Раствор хлороводорода в воде - соляная кислота - сильная кислота: 1) реагирует с металлами, стоящими в ряду напряжений до водорода: 2Al + 6HCl → 2AlCl3 + 3H2 3) с оксидами металлов: MgO + 2HCl → MgCl2 + H2O 4) с основаниями и аммиаком: HCl + KOH → KCl + H2O 3HCl + Al(OH)3 → AlCl3 + 3H2O HCl + NH3 → NH4Cl 5) с солями: CaCO3 + 2HCl → CaCl2 + H2O + CO2↑ HCl + AgNO3 → AgCl↓ + HNO3 Образование белого осадка хлорида серебра - AgCl, нерастворимого в минеральных кислотах используется в качестве качественной реакции для обнаружения анионов Cl- в растворе. Хлориды металлов - соли соляной кислоты, их получают взаимодействием металлов с хлором или реакциями соляной кислоты с металлами, их оксидами и гидроксидами; путем обмена с некоторыми солями 2Fe + 3Cl2 → 2FeCl3 Mg + 2HCl → MgCl2 + H2 CaO + 2HCl → CaCl2 + H2O Ba(OH)2 + 2HCl → BaCl2 + 2H2O Pb(NO3)2 + 2HCl → PbCl2↓ + 2HNO3 Большинство хлоридов растворимы в воде (за исключением хлоридов серебра, свинца и одновалентной ртути). Применение соляной кислоты и ее солей: 1. Соляная кислота входит в состав желудочного сока и способствует перевариванию белковой пищи у человека и животных. 2. Хлороводород и соляная кислота используются для производства лекарств, красителей, растворителей, пластмасс. 3. Применение основных солей соляной кислоты: KCl - удобрение, используется также в стекольной и химической промышленности. HgCl2 - сулема - яд, используется для дезинфекции в медицине, для протравливания семян в сельском хозяйстве. Hg2Cl2 - каломель - не ядовита, слабительное средство. NaCl - поваренная соль - сырье для производства соляной кислоты, гидроксида натрия, водорода, хлора, хлорной извести, соды. Применяется в кожевенной и мыловаренной промышленности, в кулинарии и консервировании. ZnCl2 - для пропитки древесины против гниения, в медицине, при паянии. AgCl - применяется в черно-белой фотографии, так как обладает светочувствительностью - разлагается на свету с образованием свободного серебра: 2AgCl = 2Ag + Cl2 Задания для повторения и закрепления №1. Осуществите превращения по схеме: HCl -> Cl2 -> AlCl3 - > Al(OH)3 -> Al2O3 -> AlCl3 -> Cl2 №2. Расставьте коэффициенты методом электронного баланса в следующей реакции HCl + KClO3 -> KCl + H2O + Cl2 Укажите окислитель и восстановитель; процессы окисления и восстановления. №3. Даны вещества: Zn, Cu, Al, MgO, SiO2, Fe2O3, NaOH, Al(OH)3, Fe2(SO4)3, CaCO3, Fe(NO3)3 Какие из указанных веществ будут реагировать с соляной кислотой. Составьте уравнения химических реакций №4. Решите задачу: Какое количество алюминия прореагирует с избытком соляной кислоты для получения 5,6 л водорода (н.у.)? По желанию выполнить тренажеры Тренажёр №1 - Взаимодействие металлов с соляной кислотой Тренажёр №2 - Взаимодействие оксидов металлов с соляной кислотой |
Домашнее задание:
Парагр 14-15 выучить, конспект выуч.
Письменно:
Получить всеми возможными способами хлорид калия. Указать типы реакций, для реакций обмена составить полное и сокращенное ионные уравнения.
Присылать на почту не надо, приносим на очный урок.
Выполнить рефераты на темы:
Жавелевая кислота, хлорная известь, бертолетова соль -хлорная кислота (получение, свойства , применение и практическое значение) - Ромашка В. Сенина Э., Головко Е. , остальные учащиеся готовят реферат по желанию.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|