
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Решение.Используем формулу
Пример 1 При нагревании водорода и йода в закрытом сосуде до 444ºС обратимо протекает реакция по уравнению  Н2 + I2
Н2 + I2 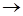 2НI. Равновесная смесь при этой температуре содержит 5,64 моль НI; 0,12 моль I2 и 5,28 моль Н2. Вычислить константу равновесия указанной реакции и исходные концентрации водорода и йода.
2НI. Равновесная смесь при этой температуре содержит 5,64 моль НI; 0,12 моль I2 и 5,28 моль Н2. Вычислить константу равновесия указанной реакции и исходные концентрации водорода и йода.
Решение. Согласно 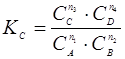 для данной реакции
для данной реакции 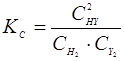

Так как данная реакция протекает без изменения объёма, то значение константы будет одинаково при всех способах выражения равновесных концентраций веществ. Вместо концентраций СНI ; СН2; СI2 можно подставить числа молей этих веществ:
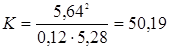
Определяем исходные концентрации йода и водорода. Согласно уравнению реакции для образования 2 моль НI расходуется по 1 моль Н2 и I2. К моменту достижения равновесия в смеси образовалось 5,64/2 моль Н2 и I2. Учитывая равновесные концентрации Н2 и I2, рассчитываем исходные концентрации этих веществ суммированием: 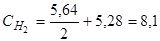 моль
моль 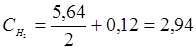 моль
моль
Пример 2 Константа равновесия реакции
СН3СООН + С2Н5СОН ® СН3СООС2Н5 + Н2О
при некоторой температуре равна 4. Определить состав реакционной смеси при равновесии, если в реакцию введены 1 моль кислоты и 2 моль спирта.
Решение. Используем формулу 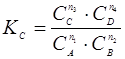 . Обозначим число молей эфира, образующего в равновесной смеси, через х. Такое же количество (х молей) выделится и воды. Количество кислоты к моменту равновесия останется (1 - х) моль, а спирта (2-х) моль. Тогда
. Обозначим число молей эфира, образующего в равновесной смеси, через х. Такое же количество (х молей) выделится и воды. Количество кислоты к моменту равновесия останется (1 - х) моль, а спирта (2-х) моль. Тогда 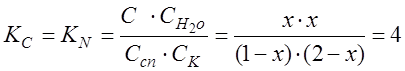 откуда х2 = 4(1- х)( 2 - х)
откуда х2 = 4(1- х)( 2 - х)
3х2 - 12х + 8 = 0.
Решая это квадратное уравнение, получим х1 = 3,154 и х2 = 0,845. Первый корень отбрасывается как не удовлетворяющий условию задачи. Таким образом, в момент установившегося равновесия состав реакционной смеси (моль): эфир 0,845; вода 0,845; уксусная кислота 0,155; спирт 1,155.
Пример 3 Константа равновесия КР реакции синтеза аммиака
N2 + 3H2 « 2NH4
при 3500С равна 2,32×10-13. Вычислить КС для этого процесса при этой же температуре.
Решение.Используем формулу
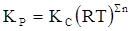 .
.
Определим Sn = 2 – 1 = – 2.
Следовательно,
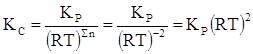
Т = 350 + 273 = 623 К;
КС = 2,32×10-13(8,314×103×623)2 = 6,224.
Пример 4 В какую сторону сместятся равновесия реакций:
1. 2СО + О2 « 2СО2 + 566,9 кДж;
2. 2Н2S « 2H2 + S2 – 41,9 кДж,
а) при повышении температуры;
б) при повышении давления?
Каким изменением концентраций можно добиться смещения равновесий приведенных реакций вправо?
Решение. Исходя из принципа Ле Шателье, можно сказать, что
а) при повышении температуры равновесие первой реакции сдвинется влево, т.к. реакция экзотермическая, а равновесие второй реакции сдвинется вправо, т.к. реакция эндотермическая.
б) при повышении давления равновесие первой реакции сдвинется в сторону прямой реакции, а равновесие второй реакции сдвинется в сторону обратной реакции, т.е. всегда в сторону меньшего объема.
Чтобы сдвинуть равновесие этих реакций вправо путем изменения концентраций, надо увеличить концентрации исходных веществ или уменьшить концентрации конечных веществ.
Пример 5 Константа равновесия КР реакции
I2 « 2I
при t1 = 6770C равна 1,149×102, а при t2 = 7770C – 7,413×102. Вычислить константу равновесия данной реакции при 7270С.
Решение. Используя уравнение
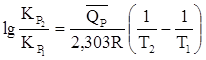 ,
,
по двум приведенным величинам КР вычисляем среднее значение теплового эффекта реакции термического разложения йода в интервале 677 – 777 0С:
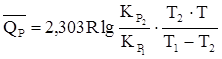 ;
;
Т1 = 950 К, Т2 = 1050 К.
 Дж/моль
Дж/моль
Т3 = 1000 К;
Определим КР3:
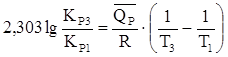 ;
;
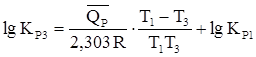 ;
;
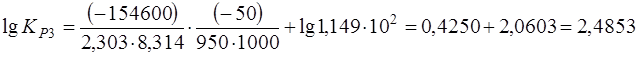 ;
;
КР3 = 3,057×102.
Вопросы для самоконтроля
1 Что такое истинное равновесие?
2 Каковы признаки истинного равновесия?
3 Вывести константы равновесия Кс и Кр и их взаимосвязь. От чего зависят и от чего не зависят эти константы равновесия?
4 Сформулировать принцип Ле Шателье.
5 Как влияют температура, давление, концентрация на смещение равновесия?
6 Для чего и как применяются уравнения изохоры и изобары?
Литература: [1], с.71-82; [2], с.152-172
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|