
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Электроотрицательность химических элементов
Электроотрицательность химических элементов
Электроотрицательность— химическое свойство атома, количественная характеристика способности атома в молекуле притягивать к себе электроны от атомов других элементов.
Современное понятие об электроотрицательности атомов было введено американским химиком Л. Полингом.
 Значения относительной электроотрицательности элементов представлены в таблице:
Значения относительной электроотрицательности элементов представлены в таблице:
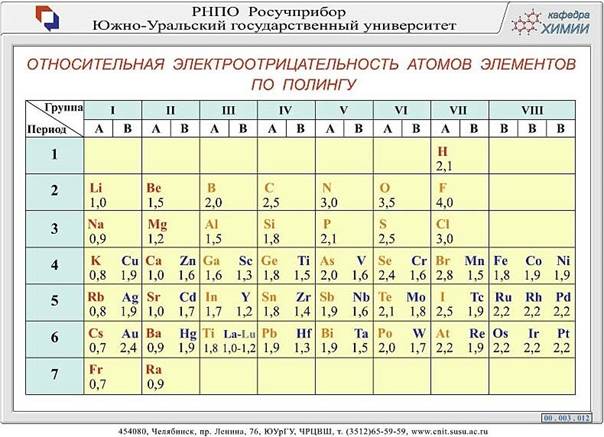 С точки зрения теории строения атомов принадлежность элементов к металлам и неметаллам определяется способностью их атомов отдавать или присоединять электроны при химических реакциях.
Наиболее сильными металлическими свойствами обладают те элементы, атомы которых легко отдают электроны. Значения их электроотрицательностей малы (χ ≤ 1).
Неметаллические свойства особенно выражены у тех элементов, атомы которых энергично присоединяют электроны.
В каждом периоде Периодической системы электроотрицательность элементов увеличивается при возрастании порядкового номера (слева направо), в каждой группе Периодической системы электроотрицательность уменьшается при возрастании порядкового номера (сверху вниз).
Элемент фтор F обладает наивысшей, а элемент цезий Cs - наименьшей электроотрицательностью среди элементов 1-6 периодов.
С точки зрения теории строения атомов принадлежность элементов к металлам и неметаллам определяется способностью их атомов отдавать или присоединять электроны при химических реакциях.
Наиболее сильными металлическими свойствами обладают те элементы, атомы которых легко отдают электроны. Значения их электроотрицательностей малы (χ ≤ 1).
Неметаллические свойства особенно выражены у тех элементов, атомы которых энергично присоединяют электроны.
В каждом периоде Периодической системы электроотрицательность элементов увеличивается при возрастании порядкового номера (слева направо), в каждой группе Периодической системы электроотрицательность уменьшается при возрастании порядкового номера (сверху вниз).
Элемент фтор F обладает наивысшей, а элемент цезий Cs - наименьшей электроотрицательностью среди элементов 1-6 периодов.
|
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|