- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Сх е м а 4.1. Образование нескольких белково-пептидных гормонов из одного белкового предшественника под действием стресса
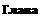 ГОРМОНАЛЬНАЯ РЕГУЛЯЦИЯ
ГОРМОНАЛЬНАЯ РЕГУЛЯЦИЯ
ФИЗИОЛОГИЧЕСКИХ ФУНКЦИЙ
Все процессы жизнедеятельности организма строго согласованы между собой по скорости, времени и месту протекания. В организме человека эту согласованность на периферии осуществляют внутриклеточные и межклеточные механизмы регуляции, важнейшую роль в которых играют гормоны. Специфические регуляторы, которые секретируются эндокринными железами в кровь или лимфу, а затем попадают на клетки-мишени, называют гормонами. Термин «гормон» происходит от греческого слова «Ьог- тао», что означает «возбуждаю, побуждаю». Первыми веществами, которые получили название гормонов, были секретин и гастрин; их открытие произошло соответственно в 1902 и 1905 гг. К. настоящему времени открыто несколько десятков гормонов.
4.1. ПРИНЦИПЫ ГОРМОНАЛЬНОЙ РЕГУЛЯЦИИ
Функциональная активность эндокринной железы может регулироваться «субстратом», на который направлено действие гормона. Так, глюкоза стимулирует секрецию инсулина из В(р)-клеток панкреатических островков (островки Лангерганса), а инсулин понижает концентрацию глюкозы в крови, активируя ее транспорт в мышцы и печень. Это происходит следующим образом. Глюкоза входит в В-клетки поджелудочной железы через переносчик глюкозы и сразу же фосфорилируется глюкокиназой, после чего вовлекается в гликолиз. Образующийся при этом АТФ ингибирует калиевые каналы, вследствие чего снижается мембранный потенциал В-клеток и активируются потенциалзависимые кальциевые каналы. Входящий в В-клетку кальций стимулирует слияние везикул, содержащих инсулин, с плазматической мембраной и выведение инсулина из В-клеток. Инсулин активирует перенос глюкозы в печень, сердце и скелетные мышцы, вследствие чего уровень глюкозы в крови снижается, замедляется ее вход в В-клетки и уменьшается секреция инсулина.
Такой же механизм лежит в основе секреции паратгормона (паратиреоидный гормон, паратирин) и кальцитонина. Оба гормона влияют на концентрацию кальция и фосфатов в крови. Паратгормон вызывает выход минеральных веществ из кости и стимулирует реабсорбцию кальция в почках и кишечнике, в результате чего возрастает концентрация кальция в плазме крови. Кальцитонин, напротив, стимулирует поступление кальция и фосфатов в костную ткань, в результате чего концентрация минеральных веществ в крови снижается. При высокой концентрации кальция в крови подавляется секреция паратгормона и стимулируется секреция кальцитонина. При снижении концентрации кальция в крови секреция паратгормона усиливается, а кальцитонина — ослабляется.
Такая регуляция постоянства внутренней среды организма, происходящая по принципу отрицательной обратной связи, очень эффективна для поддержания гомеостазиса, однако не может выполнять все задачи адаптации организма. Например, кора надпочечников продуцирует стероидные гормоны в ответ на голод, эмоциональное возбуждение и др. Чтобы эндокринная система могла «отвечать» на свет, звуки, запахи, эмоции, должна существовать связь между эндокринными железами и нервной системой.
|
|
 |
ТЛ, СЛ, ПЛ, ГЛ и КЛ — соответственно тиролиберин, соматолиберин, пролактолиберин, гонадолиберин и кортиколиберин. СС и ПС — соматостатин и пролактостатин ТТГ — ти- реотропный гормон, СТГ — соматотропный гормон (гормон роста). Пр — пролактин, ФСГ — фолликулостимулирующий гормон, ЛГ — лютеинизирующий гормон, АКТГ — адренокортикотропный гормон.
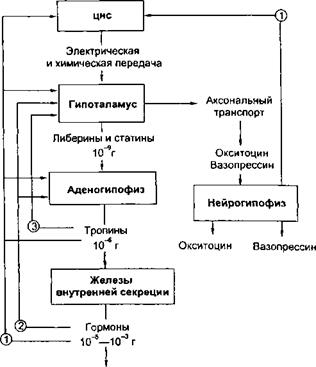
Основные связи между нервной и эндокринной системами регуляции осуществляются посредством взаимодействия гипоталамуса и гипофиза. Нервные импульсы, приходящие в гипоталамус, активируют секрецию так называемых рилизинг-факторов (либерины и статины): тиреолиберина, со- матолиберина, пролактолиберина, гонадолиберина и кортиколиберина, а также соматостатина и пролактостатина. Мишенью для либеринов и статинов, секретируемых гипоталамусом, является гипофиз (рис.4.1). Каждый из либеринов взаимодействует с определенной популяцией клеток гипофиза и вызывает в них синтез соответствующих тропинов', тиреотропина, соматотропного гормона (соматотропин — гормон роста), пролактина, гонадотропного гормона (гонадотропины — лютеинизирующий и фолликулостимулирующий), а также адренокортикотропного гормона (АКТГ, кортикотропин). Статины оказывают на гипофиз влияние, противоположное 200
Рис. 4.2.Прямые и обратные связи в нейроэндокринной системе.
1 — медленно развивающееся и продолжительное ингибирование секреции гормонов и нейромедиаторов, а также изменение поведения и формирование памяти; 2 — быстро развивающееся, но продолжительное ингибирование; 3 — кратковременное ингибирование
|
|
Гормон роста стимулирует рост костей, скелетных мышц, внутренних органов, клетки иммунной системы. Пролактин способствует формированию молочных желез и образованию в них молока, стимулирует родительский инстинкт. Оба этих гормона относятся к цитокинам, так как действуют на клетку через цитокиновые рецепторы, стимулирующие тирозиновое фосфорилирование белков.
Тиреотропный, лютеинизирующий и фолликулостимулирующий гормоны влияют на свои ткани-мишени путем активации в них синтеза цАМФ. Тиреотропный гормон действует на щитовидную железу и стимулирует в ней секрецию тироксина и трийодтиронина. У женщин фолликулостимулирующий гормон стимулирует созревание фолликул яичника и синтез в них эстрогенов, а у мужчин усиливает сперматогенез. Другой гонадотропин, лютеинизирующий гормон, стимулирует образование андрогенов в семенниках и яичниках, эстрогенов — в яичниках.
Регуляция деятельности гипофиза и гипоталамуса, кроме сигналов, идущих «сверху вниз», осуществляется гормонами исполнительных желез (рис. 4.2). Эти обратные сигналы поступают в гипоталамус и затем передаются в гипофиз, что приводит к изменению секреции соответствующих тропинов. После удаления или атрофии эндокринной железы стимулируется секреция соответствующего тропного гормона; при гиперфункции железы секреция соответствующего тропина подавляется. Обратные связи не только позволяют регулировать концентрацию гормонов в крови, но и участвуют в дифференцировке гипоталамуса в онтогенезе. Образование половых гормонов в женском организме происходит циклически, что объясняется циклической секрецией гонадотропных гормонов. Синтез этих гормонов контролируется гипоталамусом, образующим рилизинг-фактор этих тропинов (гонадолиберин). Если самке пересадить гипофиз самца, то пересаженный гипофиз начинает функционировать циклично. Половая дифференцировка гипоталамуса происходит под действием андрогенов. Если самца лишить половых желез, продуцирующих андрогены, то гипоталамус будет дифференцироваться по женскому типу.
В железах внутренней секреции иннервированы, как правило, только сосуды, а эндокринные клетки изменяют свою активность лишь под действием метаболитов, кофакторов и гормонов, причем не только гипофизарных. Так, ангиотензин II стимулирует синтез и секрецию альдостерона. Некоторые гормоны гипоталамуса и гипофиза могут образовываться не только в этих тканях. Например, соматостатин обнаружен также в поджелудочной железе, где он подавляет секрецию инсулина и глюкагона.
Большинство нервных и гуморальных путей регуляции сходятся на уровне гипоталамуса, и благодаря этому в организме образуется единая нейроэндокринная регуляторная система. К клеткам гипоталамуса подходят аксоны нейронов, расположенных в коре большого мозга и подкорковых образованиях. Эти аксоны секретируют различные нейромедиаторы, оказывающие на секреторную активность гипоталамуса как активирующее, так и тормозное влияние. Поступающие из мозга нервные импульсы гипоталамус превращает в эндокринные стимулы, которые могут быть усилены или ослаблены в зависимости от гуморальных сигналов, поступающих в гипоталамус от желез и тканей, подчиненных ему.
Тропины, образующиеся в гипофизе, не только регулируют деятельность подчиненных желез, но и выполняют самостоятельные эндокринные функции. Например, пролактин оказывает лактогенное действие, а также тормозит процессы дифференцировки клеток, повышает чувствительность половых желез к гонадотропинам, стимулирует родительский инстинкт. Кортикотропин является не только стимулятором стероидогенеза, но и активатором липолиза в жировой ткани, а также важнейшим участником процесса превращения в мозге кратковременной памяти в долговременную. Гормон роста может стимулировать активность иммунной системы, обмен липидов, сахаров и др.
В задней доле гипофиза (нейрогипофиз) депонируются антидиуретиче- ский гормон (вазопрессин) и окситоцин. Первый вызывает задержку воды в организме и повышает тонус сосудов, второй стимулирует сокращение матки при родах и секрецию молока. Оба гормона синтезируются в гипоталамусе, затем транспортируются по аксонам в заднюю долю гипофиза, где депонируются и потом секретируются в кровь.
Характер процессов, протекающих в ЦНС, во многом определяется состоянием эндокринной регуляции. Так, андрогены и эстрогены формируют половой инстинкт, многие поведенческие реакции. Очевидно, что нейроны, точно так же как и другие клетки нашего организма, находятся под контролем гуморальной системы регуляции. Нервная система, эволюционно более поздняя, имеет как управляющие, так и подчиненные связи с эндокринной системой. Эти две регуляторные системы дополняют друг друга, образуют функционально единый механизм.
4.2. МЕТОДЫ ИССЛЕДОВАНИЯ
Для изучения функций желез внутренней секреции используются экспериментальные и клинические методы исследования. К наиболее важным из них следует отнести следующие.
▲ Изучение последствий удаления (экстирпация) эндокринных желез.После удаления какой-либо эндокринной железы возникает комплекс расстройств, обусловленных выпадением регуляторных эффектов тех гормонов, которые вырабатываются в этой железе. Например, предположение о наличии эндокринных функций у поджелудочной железы нашло подтверждение в опытах И. Меринга и О. Минковского (1889), показавших, что ее удаление у собак приводит к выраженной гипергликемии и глюкозурии; животные погибали в течение 2—3 нед после операции на фоне явлений тяжелого сахарного диабета. В последующем было установлено, что эти изменения возникают из-за недостатка инсулина — гормона, образующегося в островковом аппарате поджелудочной железы.
Вследствие травматичности оперативного вмешательства вместо хирургического удаления эндокринной железы может быть использовано введение химических веществ, нарушающих их гормональную функцию. Например, введение животным аллоксана нарушает функцию В-клеток поджелудочной железы, что приводит к развитию сахарного диабета, проявления которого практически идентичны расстройствам, наблюдаемым после экстирпации поджелудочной железы.
▲ Наблюдение эффектов, возникших при имплантации желез.Животному с удаленной эндокринной железой можно ее имплантировать заново в хорошо васкуляризированную область тела, например под капсулу почки или в переднюю камеру глаза. Такая операция называется реимплантацией. Для ее проведения обычно используют эндокринную железу, полученную от животного-донора. После реимплантации постепенно восстанавливается уровень гормонов в крови, что приводит к исчезновению нарушений, возникших ранее в результате дефицита этих гормонов в организме. Например, Бертольдом (1849) было показано, что у петухов пересадка половых желез в брюшную полость после кастрации предотвращает развитие посткастрационного синдрома. Возможна также пересадка эндокринной железы животному, у которого операция экстирпации ранее не производилась. Последнее может быть использовано для изучения эффектов, возникающих при избытке гормона в крови, так как его секреция в данном случае осуществляется не только собственной эндокринной железой животного, но и имплантированной.
▲ Изучение эффектов, возникших при введении экстрактов эндокринных желез.Нарушения, возникшие после хирургического удаления эндокринной железы, могут быть корректированы посредством введения в организм достаточного количества экстракта данной железы или соответствующего гормона.
д Использование радиоактивных изотопов.Иногда для исследования функциональной активности эндокринной железы может быть использована ее способность извлекать из крови и накапливать определенное соединение. Например, щитовидная железа активно поглощает йод, который затем используется для синтеза тироксина и трийодтиронина. При гиперфункции щитовидной железы накопление йода усиливается, при гипо
функции наблюдается обратное явление. Интенсивность накопления йода может быть определена путем введения в организм радиоактивного изотопа 1311 с последующей оценкой радиоактивности щитовидной железы. В качестве радиоактивной метки вводят также соединения, которые используются для синтеза эндогенных гормонов и включаются в их структуру. В последующем можно определить радиоактивность различных органов и тканей и оценить, таким образом, распределение гормона в организме, а также найти его органы-мишени.
▲ Определение количественного содержания гормона.В ряде случаев для выяснения механизма какого-либо физиологического эффекта целесообразно сопоставить его динамику с изменением количественного содержания гормона в крови или в другом исследуемом материале.
К наиболее современным относятся методы радиоиммунологического определения концентрации гормонов в крови. Эти методы основаны на том, что меченный радиоактивной меткой гормон и гормон, содержащийся в исследуемом материале, конкурируют между собой за связывание со специфическими антителами: чем больше в биологическом материале содержится данного гормона, тем меньше свяжется меченых молекул гормона, так как количество гормонсвязывающих участков в образце постоянно.
▲ Важное значение для понимания регуляторных функций желез внутренней секреции и диагностики эндокринной патологии имеют клинические методы исследования.К ним относятся диагностика типичных симптомов избытка или недостатка того или иного гормона, использование различных функциональных проб, рентгенологические, лабораторные и другие методы исследования.
4.3. ОБРАЗОВАНИЕ, ВЫВЕДЕНИЕ ИЗ ЭНДОКРИННЫХ КЛЕТОК, ТРАНСПОРТ КРОВЬЮ И МЕХАНИЗМЫ ДЕЙСТВИЯ ГОРМОНОВ
4.3.1. Синтез гормонов
В поддержании упорядоченности, согласованности всех физиологических и метаболических процессов в организме участвует более 100 гормонов и нейромедиаторов. Их химическая природа различна (белки, полипептиды, пептиды, аминокислоты и их производные, стероиды, производные жирных кислот, некоторые нуклеотиды, эфиры и др.). У каждого класса этих веществ пути образования и распада разные.
Белково-пептидные гормонывключают все тропные гормоны, либерины и статины, инсулин, глюкагон, кальцитонин, гастрин, секретин, холецистокинин, ангиотензин II, антидиуретический гормон (вазопрессин), паратгормон и др.
Эти гормоны образуются из белковых предшественников, называемых прогормонами. Как правило, сначала синтезируется препрогормон, из которого образуется прогормон, а затем гормон.
Синтез прогормонов осуществляется на мембранах гранулярной эндоплазматической сети (шероховатый ретикулум) эндокринной клетки.
Везикулы с образующимся прогормоном переносятся затем в пластинчатый комплекс Гольджи, где под действием мембранной протеиназы от молекулы прогормона отщепляется определенная часть аминокислотной цепи. В результате образуется гормон, который поступает в везикулы, со- 204
держащиеся в комплексе Гольджи. В дальнейшем эти везикулы сливаются с плазматической мембраной и высвобождаются во внеклеточное пространство.
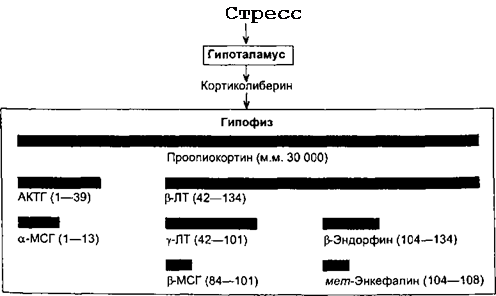
Поскольку многие полипептидные гормоны образуются из общего белкового предшественника, изменение синтеза одного из этих гормонов может приводить к параллельному изменению (ускорение или замедление) синтеза ряда других гормонов. Так, из белка проопиокортина образуются кортикотропин и p-липотропин (схема 4.1), из p-липотропина может образоваться еще несколько гормонов: у-липотропин, р-меланоцитостимулиру- ющий гормон, p-эндорфин, у-эндорфин, а-эндорфин, метионин-энкефа- лин.
При действии специфических протеиназ из кортикотропина могут образовываться а-меланоцитостимулируюший гормон и АКТГ-подобный пептид аденогипофиза. Благодаря сходству структур кортикотропина и а-меланоцитостимулирующего гормона, последний имеет слабую кортикотропную активность. Кортикотропин обладает незначительной способностью усиливать пигментацию кожи.
Концентрация белково-пептидных гормонов в крови варьирует в пределах от 10“6 до 10-12 М. При стимуляции эндокринной железы концентрация соответствующего гормона возрастает в 2—5 раз. Так, например, в состоянии покоя в крови человека содержится около 0,2 мкг АКТГ (в расчете на 5 л крови), а при стрессе это количество возрастает до 0,8—1,0 мкг. В нормальных условиях в крови содержится 0,15 мкг глюкагона и 5 мкг инсулина. Когда человек голоден, содержание глюкагона может повышаться до 1 мкг, а содержание инсулина снижаться на 40—60 %. После сытного обеда концентрация глюкагона в крови в 1,5—2,8 раза снижается, а содержание инсулина повышается до 10—25 мкг.
Сх е м а 4.1. Образование нескольких белково-пептидных гормонов из одного белкового предшественника под действием стресса
 |
Полупериод жизни белково-пептидных гормонов в крови составляет 10—20 мин. Они разрушаются протеиназами клеток-мишеней крови, печени, почек.
Стероидные гормонывключают тестостерон, эстрадиол, эстрон, прогестерон, кортизол, альдостерон и др. Эти гормоны образуются из холестерина в корковом веществе надпочечников (кортикостероиды), а также в семенниках и яичниках (половые стероиды).
В малом количестве половые стероиды могут образовываться в корковом веществе надпочечников, а кортикостероиды — в половых железах. Свободный холестерин поступает в митохондрии, где превращается в прегненолон, который затем попадает в эндоплазматическую сеть и после этого — в цитоплазму.
В корковом веществе надпочечников синтез стероидных гормонов стимулируется кортикотропином, а в половых железах — лютеинизирующим гормоном (ЛГ). Эти гормоны ускоряют транспорт эфиров холестерина в эндокринные клетки и активируют митохондриальные ферменты, участвующие в образовании прегненолона. Кроме того, тропные гормоны активируют процессы окисления сахаров и жирных кислот в эндокринных клетках, что обеспечивает стероидогенез энергией и пластическим материалом.
Кортикостероиды подразделяют на две группы. Глюкокортикоиды (типичный представитель — кортизол) индуцируют синтез ферментов глюконеогенеза в печени, препятствуют поглощению глюкозы мышцами и жировыми клетками, а также способствуют высвобождению из мышц молочной кислоты и аминокислот, тем самым ускоряя глюконеогенез в печени.
Стимуляция синтеза глюкокортикоидов осуществляется через систему гипоталамус—гипофиз—надпочечники. Стресс (эмоциональное возбуждение, боль, холод и др.), тироксин, адреналин и инсулин стимулируют высвобождение кортиколиберина из аксонов гипоталамуса. Этот гормон связывается с мембранными рецепторами аденогипофиза и вызывает высвобождение кортикотропина, который с током крови попадает в надпочечники и стимулирует там образование глюкокортикоидов — гормонов, повышающих устойчивость организма к неблагоприятным воздействиям.
Минералокортикоиды (типичный представитель — альдостерон) задерживают натрий в крови. Снижение концентрации натрия в выделяемой моче, а также в секретах слюнных и потовых желез приводит к меньшим потерям воды, так как вода движется через биологические мембраны в направлении высокой концентрации солей.
Кортикотропин влияет слабо на синтез минералокортикоидов. Имеется дополнительный механизм регуляции синтеза минералокортикоидов, осуществляющийся через так называемую ренин-ангиотензиновую систему. Рецепторы, реагирующие на давление крови, локализованы в артериолах почек. При снижении давления крови эти рецепторы стимулируют секрецию ренина почками. Ренин является специфической эндопептидазой, отщепляющей от а2-глобулина крови С-концевой декапептид, который называют «ангиотензин /». От ангиотензина I карбоксипептидаза (ангиотен- зинпревращающий фермент, АПФ, расположенный на наружной поверхности эндотелия кровеносных сосудов) отщепляет два аминокислотных остатка и образует октапептид ангиотензин II — гормон, к которому на мембране клеток коркового вещества надпочечников имеются специаль- 206
ные рецепторы. Связываясь с этими рецепторами, ангиотензин II стимулирует образование альдостерона, который действует на дистальные канальцы почек, потовые железы, слизистую оболочку кишечника и увеличивает в них реабсорбцию ионов Na+, С1_ и HCOj. В результате в крови повышается концентрация ионов Na+ и снижается концентрация ионов К+ Эти эффекты альдостерона полностью блокируются ингибиторами синтеза белка.
В крови человека около 500 мкг кортизола. При стрессе его содержание повышается до 2000 мкг. Альдостерона в 1000 раз меньше — около 0,5 мкг. Если человек находится на бессолевой диете, содержание альдостерона повышается до 2 мкг.
Половые стероиды. Андрогены (мужские половые гормоны) продуцируются интерстициальными клетками яичек и в меньшем количестве яичниками и корковым веществом надпочечников. Основным андрогеном является тестостерон. Этот гормон может претерпевать изменения в клетке-мишени — превращаться в дигидротестостерон, который обладает большей активностью, чем тестостерон. ЛГ, который стимулирует начальные этапы биосинтеза стероидов в эндокринной железе, активирует также превращение тестостерона в дигидротестостерон в клетке-мишени, тем самым усиливая андрогенные эффекты.
Яичники секретируют эстрадиол, андростендион и прогестерон. Фолликул яичника представляет собой яйцеклетку, окруженную плоскими эпителиальными клетками и соединительнотканной оболочкой. Изнутри эта капсула заполнена фолликулярной жидкостью и зернистыми клетками.
При половом созревании синтез этих гормонов начинает контролироваться гонадотропинами. При этом фолликулостимулирующий гормон (ФСГ) стимулирует стероидогенез в зернистых клетках, погруженных во внутреннее пространство фолликула, а лютеинизирующий гормон (ЛГ) действует на клетки, формирующие оболочку капсулы. Так как в оболочке образуются мужские половые гормоны (андростерон и тестостерон), а в зернистых клетках они превращаются в женские половые гормоны (эстрон и эстрадиол), очевидно, что для продукции женских половых стероидов должна осуществляться строгая согласованность синтеза и секреции гонадотропинов в гипофизе.
Образование в гипоталамусе гонадолиберина и стимуляция им секреции ФСГ и ЛГ инициирует механизмы полового созревания. Время начала секреции и количество секретируемого гонадолиберина детерминировано генетически, однако на его секрецию влияют также нейромедиаторы ЦНС: норадреналин, дофамин, серотонин и эндорфины.
Высвобождение гонадолиберина из гипоталамуса обычно происходит во время коротких по своей продолжительности периодов секреции, между которыми наблюдается 2—3-часовая «пауза». Спустя несколько минут после выведения гонадолиберина в крови появляются гонадотропины. Секреция гонадотропинов зависит также от уровня половых стероидов в крови: эстрогены подавляют выведение ФСГ и стимулируют секрецию ЛГ гипофизом, а прогестерон тормозит секрецию гонадолиберина в гипоталамусе. Таким образом замыкаются регуляторные связи между сигналами из ЦНС и активностью яичников, осуществляющих стероидогенез.
Ключевую роль в циклическом функционировании женских половых желез играет ФСГ, секреция которого стимулируется гонадолиберином и низким уровнем эстрогенов. ФСГ проводит селекцию только одной из
фолликул (доминантная), которая вступает в менструальный цикл. После этого резко усиливается синтез эстрогенов, что вызывает (по механизму отрицательной обратной связи) снижение уровня ФСГ Почти одновременно с этим наблюдается резкий подъем уровня ЛГ, который стимулирует созревание доминантной фолликулы, ее разрыв и выход яйцеклетки. Сразу же после этого снижается продукция эстрогенов, что приводит (по механизму отрицательной обратной связи) к подавлению секреции ЛГ Наступает фаза созревания желтого тела, которая сопровождается перемещением яйцеклетки в матку. Это «путешествие» длится 8—9 дней, и, если не происходит оплодотворения яйцеклетки, желтое тело постепенно снижает продукцию эстрогенов и прогестерона, в результате чего наступает менструация.
Эстрогены (женские половые гормоны) в организме человека в основном представлены эстрадиолом. В клетках-мишенях они не метаболизируются.
Действие андрогенов и эстрогенов направлено в основном на органы воспроизведения, проявление вторичных половых признаков, поведенческие реакции. Андрогенам свойственны также анаболические эффекты — усиление синтеза белка в мышцах, печени, почках. Эстрогены оказывают катаболическое влияние на скелетные мышцы, но стимулируют синтез белка в сердце и печени. Таким образом, основные эффекты половых гормонов опосредуются процессами индукции и репрессии синтеза белка.
Стероидные гормоны легко проникают через клеточную мембрану, поэтому их выведение из клетки происходит параллельно с синтезом гормонов. Содержание стероидов в крови определяется соотношением скоростей их синтеза и распада. Регуляция этого содержания осуществляется главным образом путем изменения скорости синтеза. Тропные гормоны (кортикотропин, ЛГ и ангиотензин) стимулируют этот синтез. Устранение тропного влияния приводит к торможению синтеза стероидных гормонов.
У мужчин содержание в крови тестостерона (20—40 мкг) больше, чем у женщин (2—4 мкг). Содержание эстрадиола у женщин (0,25—2,5 мкг, а при беременности 50—100 мкг) большее, чем у мужчин (0,1—0,2 мкг), 90—95 % стероидных гормонов в крови обычно находится в связанном состоянии с белками плазмы.
Действующие концентрации стероидных гормонов составляют 10"’1—10~9 М. Период их полураспада равен '/2—1'/2 я.
Тиреоидные гормонывключают тироксин и трийодтиронин. Синтез этих гормонов осуществляется в щитовидной железе, в которой ионы йода окисляются при участии пероксидазы до йодиниум-иона, способного йодировать тиреоглобулин — тетрамерный белок, содержащий около 120 тирозинов. Йодирование тирозиновых остатков происходит при участии пероксида водорода и завершается образованием монойодтирозинов и дийодтирозинов. После этого происходит «сшивка» двух йодированных тирозинов. Эта окислительная реакция протекает с участием пероксидазы и завершается образованием в составе тиреоглобулина трийодтирони- на и тироксина. Для того чтобы эти гормоны освободились из связи с белком, должен произойти протеолиз тиреоглобулина. При расщеплении одной молекулы этого белка образуется 2—5 молекул тироксина (Т4) и трийодтиронина (Т3), которые секретируются в молярных соотношениях, равных 4:1.
Синтез и выведение тиреоидных гормонов из продуцирующих их клеток находятся под контролем гипоталамо-гипофизарной системы. Тиреотропин активирует аденилатциклазу щитовидной железы, ускоряет актив- 208
ный транспорт йода, а также стимулирует рост эпителиальных клеток щитовидной железы. Эти клетки формируют фолликул, в полости которого происходит йодирование тирозина. Адреналин и простагландин Е2 также могут повышать концентрацию цАМФ в щитовидной железе, при этом они вызывают такое же стимулирующее влияние на синтез тироксина, как и тиреотропин.
Активный транспорт ионов йода в железу при действии тиреотропина происходит против 500-кратного градиента. Тиреотропин стимулирует также синтез рибосомальной РНК и мРНК тиреоглобулина, т.е. происходит усиление как транскрипции, так и трансляции белка, служащего источником тирозинов для синтеза Т3 и Т4. Выведение Т3 и Т4 из клеток — их продуцентов — осуществляется посредством пиноцитоза. Частички коллоида окружаются мембраной эпителиальной клетки и поступают в цитоплазму в виде пиноцитозных пузырьков. При слиянии этих пузырьков с лизосомами эпителиальной клетки происходит расщепление тиреоглобулина, который составляет основную массу коллоида, что приводит к выделению Т3 и Т4. Тиреотропин и другие факторы, повышающие концентрацию цАМФ в щитовидной железе, стимулируют пиноцитоз коллоида, процесс образования и движения секреторных пузырьков. Таким образом, тиреотропин ускоряет не только синтез, но и выведение Т3 и Т4 из клеток- продуцентов. При повышении уровня Т3 и Т4 в крови подавляется секреция тиреолиберина и тиреотропина.
Тиреоидные гормоны могут циркулировать в крови в неизменном виде в течение нескольких дней. Такая устойчивость гормонов объясняется, по-видимому, образованием прочной связи с Т4-связывающими глобулинами и преальбуминами в плазме крови. Эти белки имеют в 10—100 раз большее сродство к Т4, чем к Т3, поэтому в крови человека содержится 300—500 мкг Т4 и лишь 6—12 мкг Т3.
Катехоламинывключают адреналин, норадреналин и дофамин. Источником катехоламинов, как и тиреоидных гормонов, служит тирозин. Катехоламины, образующиеся в мозговом веществе надпочечников, выделяются в кровь, а не в синаптическую щель, т.е. являются типичными гормонами.
В некоторых клетках синтез катехоламинов заканчивается образованием дофамина, а адреналин и норадреналин образуются в меньшем количестве. Такие клетки есть в составе гипоталамуса.
Синтез катехоламинов в мозговом веществе надпочечников стимулируется нервными импульсами, поступающими по чревному симпатическому нерву. Выделяющийся в синапсах ацетилхолин взаимодействует с холинергическими рецепторами никотинового типа и возбуждает нейросекреторную клетку надпочечника. Благодаря существованию нервно-рефлекторных связей надпочечники отвечают усилением синтеза и выделения катехоламинов в ответ на болевые и эмоциональные раздражители, гипоксию, мышечную нагрузку, охлаждение и др. Подобный тип регуляции эндокринной железы, являющийся исключением из обычного правила, можно объяснить тем, что мозговой слой надпочечника в эмбриогенезе образуется из нервной ткани, поэтому у него сохраняется типичный нейрональный тип регуляции. Существуют и гуморальные пути регуляции активности клеток мозгового вещества надпочечников: синтез и выделение катехоламинов могут возрастать под действием инсулина, глюкокортикоидов при гипогликемии.
Катехоламины подавляют как собственный синтез, так и выделение. В адренергических синапсах на пресинаптической мембране есть а-адре-
нергические рецепторы. При выбросе катехоламинов в синапс эти рецепторы активируются и оказывают ингибирующее влияние на секрецию катехоламинов.
Гематоэнцефалический барьер не пропускает катехоламины из крови в мозг. В то же время диоксифенилаланин, их предшественник, легко проникает через этот барьер и может усилить образование катехоламинов в мозге.
Катехоламины инактивируются в тканях-мишенях, печени и почках. Решающее значение в этом процессе играют два фермента — моноаминоксидаза, расположенная на внутренней мембране митохондрий, и кате- хол-О-метилтрансфераза, цитозольный фермент.
Эйкозаноидывключают простагландины, тромбоксаны и лейкотриены. Эйкозаноиды называют гормоноподобными веществами, так как они могут оказывать только местное действие, сохраняясь в крови в течение нескольких секунд. Образуются во всех органах и тканях практически всеми типами клеток.
Биосинтез большинства эйкозаноидов начинается с отщепления арахидоновой кислоты от мембранного фосфолипида или диацилглицерина в плазматической мембране. Синтетазный комплекс представляет собой полиферментную систему, функционирующую преимущественно на мембранах эндоплазматической сети. Образующиеся эйкозаноиды легко проникают через плазматическую мембрану клетки, а затем через межклеточное пространство переносятся на соседние клетки и выходят в кровь и лимфу. Наиболее интенсивно простагландины образуются в яичках и яичниках.
Простагландины могут активировать аденилатциклазу, тромбоксаны увеличивают активность фосфоинозитидного обмена, а лейкотриены повышают проницаемость мембран для Са2+ Поскольку цАМФ и Са2+ стимулируют синтез эйкозаноидов, замыкается положительная обратная связь в синтезе этих специфических регуляторов.
Период полураспада эйкозаноидов составляет 1—20 с. Ферменты, инактивирующие их, имеются практически во всех тканях, но наибольшее их количество содержится в легких.
4.3.2. Выведение гормонов из клеток-продуцентов
и транспорт гормонов кровью
Стероидные гормоны благодаря своей липофильности не накапливаются в эндокринных клетках, а легко проходят через мембрану и поступают в кровь и лимфу. В связи с этим регуляция содержания этих гормонов в крови осуществляется путем изменения скорости их синтеза.
Тиреоидные гормоны также липофильны и также легко проходят через мембрану, однако они ковалентно связаны в эндокринной железе с тиреоглобулином, поэтому могут выводиться из клетки только после нарушения этой связи. Чем больше йодированных тирозилов в составе тиреоглобулина и чем выше скорость протеолиза йодированного белка, тем больше тиреоидных гормонов в крови. Регуляция содержания тиреоидных гормонов осуществляется двумя путями — ускорением как процессов йодирования, так и разрушения тиреоглобулина.
Гормоны, имеющие белковую и пептидную природу, а также катехоламины, гистамин, серотонин и др. — это гидрофильные вещества, которые не могут диффундировать через клеточную мембрану. Для выведения этих 210
молекул созданы специальные механизмы, чаще всего пространственно и функционально разобщенные с процессами биосинтеза.
Многие белково-пептидные гормоны образуются из предшественников большой молекулярной массы, и выведение этих гормонов становится возможным только после того, как произойдет отщепление «лишнего» фрагмента. Так, выведению инсулина из клетки предшествует превращение в В-клетках поджелудочной железы препроинсулина в проинсулин, а затем в инсулин. Биосинтез инсулина и других белково-пептидных гормонов, а также их транспорт к периферии секреторной клетки занимает обычно 1—3 ч. Очевидно, что воздействие на биосинтез приведет к изменению уровня белкового гормона в крови лишь через несколько часов. Влияние же на выведение этих гормонов, синтезированных «впрок» и запасенных в специальных везикулах, позволяе
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|