
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Практическая работа №. Получение аммиака и изучение его свойств». Цель: Получить аммиак и ознакомиться со свойствами водного раствора аммиака.. Ход работы
Практическая работа №
«Получение аммиака и изучение его свойств»
Цель: Получить аммиак и ознакомиться со свойствами водного раствора аммиака.
Оборудование:лабораторный штатив, сухие пробирки, пробка с газоотводной трубкой, ступка, ложки для сыпучих веществ, спиртовка, спички, стакан с водой.
Реактивы: кристаллический гидроксид кальция, кристаллический хлорид аммония, раствор соляной кислоты, раствор ф – ф.
ТБ:
Ход работы
| № | Что делали | Что наблюдали | Уравнения реакций в молекулярном, полном и сокращенном ионном виде | Выводы. |
| 1.Получение аммиака и исследование его физических свойств. | Получаем аммиак нагреванием смеси гидроксида кальция и хлорида аммония в пробирке
 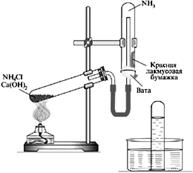 Собираем аммиак в пробирку дном ...
Собираем аммиак в пробирку дном ...
| Разрыхление реакционной массы. Образование тумана. Индикаторная бумага окрасилась в ... | О выделении какого газа свидетельствуют наблюдения ? Написать уравнение реакции: Ca(OH)2 + NH4Cl = ... + NH3↑ + ... |
Физические свойства аммиака: ......... Аммиак ... воздуха, поэтому сухая пробирка – приемник находится дном... .
Mr(NH3) = ...
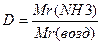 = ... = ...
|
| 2. Исследование химических свойств аммиака 1. Растворение аммиака в воде. .Изучение кислотно-основных свойств водного раствора аммиака. 3.Взаимодействие с кислотами: | Сняв с газоотводной трубки прибора пробирку, помещаем её в химический стакан с водой. Убираем из стакана пробирку и в образовавшийся раствор добавляем фенолфталеин . В стакан с водным раствором аммиака в присутствии фенолфталеина вливают 1мл раствора серной кислоты | Пробирка наполняется водой. Раствор приобретает ... | Написать уравнение реакции, назвать образующееся вещество: NH3 + H2O ⇄ NH4OH + ... = ... + ... NH4OH + H+ + ... = NH4+ + ... + ... NH4OH + H+ = NH4+ + H2O | Аммиак ... растворим в воде . Продукт взаимодействия аммиака с водой называется ... . Относится к классу ... . Механизм образования химической связи в катионе ... . Тип реакции ... . Почему исчезла первоначальная окраска раствора? Название продукта взаимодействия гидроксида аммония с соляной кислотой ... . К какому классу относится продукт реакции? ... Тип реакции ... |
| 4. Окислительно-восстановительные свойства аммиака | На основе электронного баланса написать уравнение реакции, определить окислитель и восстановитель: а) Горение аммиак без катализатора б) Горение аммиак в присутствии катализатора | Какие вещества образуются в процессе горения аммиака а) без катализатора; б) в присутствии катализатора? | ||
| Вывод: | ||||
Задания.
1) Какая масса хлорида аммония получится при взаимодействии 3 моль аммиака с соляной кислотой?
2) Какой объем кислорода потребуется для сжигания 34 г аммиака?
3) Закончите уравнения химических реакций, дайте названия продуктам реакций:
а) NH3 + HNO3 =...
б) NH3 + H2SO4 = ...
в) NH3 + H2SO4 = ...
избыток
г) NH3 + H3PO4= ...
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|