
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Конспект лекций по теплотехнике
Конспект лекций по теплотехнике
Раздел I. Техническая термодинамика
Тема 2. Первый закон термодинамики
В общем случае внутренней энергией называется совокупность всех видов энергий, заключенной в теле или системе тел. Эту энергию можно представить как сумму отдельных видов энергий: кинетической энергии молекул (поступательного и вращательного движения молекул); колебательного движения атомов в самой молекуле; энергии электронов; внутриядерной энергии; энергии взаимодействия между ядром молекулы и электронами.
В технической термодинамике рассматриваются только такие процессы, в которых изменяются кинетическая и потенциальная составляющие внутренней энергии. При этом знание абсолютных значений внутренней энергии не требуется. Поэтому внутренней энергией для идеальных газов называют кинетическую энергию движения молекул и энергию колебательных движений атомов в молекуле, а для реальных газов дополнительно включают потенциальную энергию молекул. Внутренняя энергия (U) является функцией двух основных параметров состояния газа, т.е. U = f (P, T), U = f (υ, T) U= f (P, υ).
Каждому состоянию рабочего тела (системы) соответствует вполне определенное значение параметров состояния, то для каждого состояния газа будет характерна своя однозначная, вполне определенная величина внутренней энергии U. То есть U является функцией состояния газа. И разность внутренних энергий для двух каких-либо состояний рабочего тела или системы тел не будет зависеть от пути перехода от первого состояния во второе. [1]
Внутренняя энергия – функция состояния закрытой термодинамической системы, определяемая тем, что ее приращение в любом процессе, происходящем в этой системе, равно сумме теплоты, сообщенной системе, и работы, совершенной над ней. Если рабочее тело – идеальный газ, то внутренняя энергия зависит только от температуры.
Для процесса идеального газа изменение внутренней энергии 1 2 u∆ − равно:
u C (t t) 2 1 t t 1 2 vm 2 1 ∆ − = − . (1)
Приближенная формула (C const):
v = u C (t t) ∆ 1−2 = v 2 − 1. (2)
Условно принимают, что при нормальных условиях (t = 0 °C) внутренняя энергия равна 0, тогда в данном состоянии, характеризуемом температурой t, внутренняя энергия u равна: u C t t 0 = vm. (3)
Приближенная формула (C const): v = u C t = v. (4)[2]
Литература
1. 1. Кудинов В.А., Карташов Э.М. Техническая термодинамика. –М.; Высш.шк., 2000. –261 с.ил.
2. Сборник задач по технической термодинамике: учебное пособие / Д. Л. Жуховицкий. – 2-е изд. – Ульяновск: УлГТУ, 2004. – 98 с. ISBN 5-89146-520-0
Приложение1

Рисунок 1……………………………………….

Рисунок 2………………………………………….
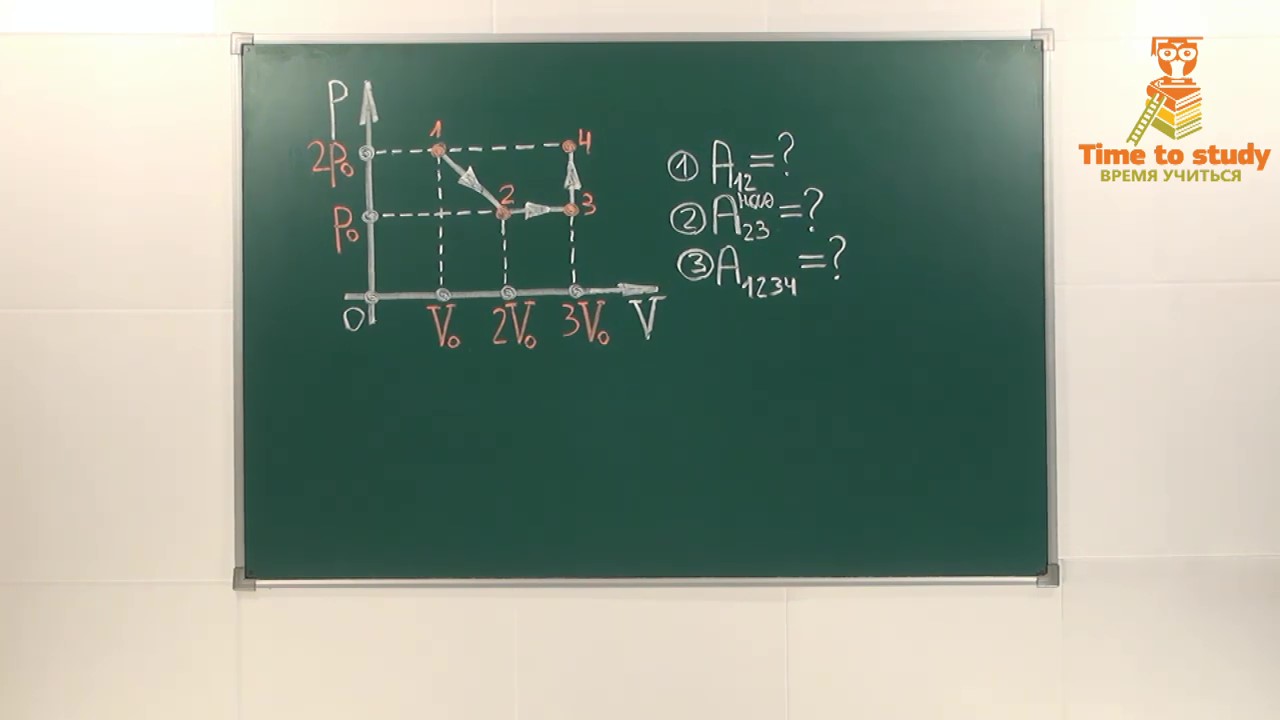
Рисунок 3…………………………………………………….
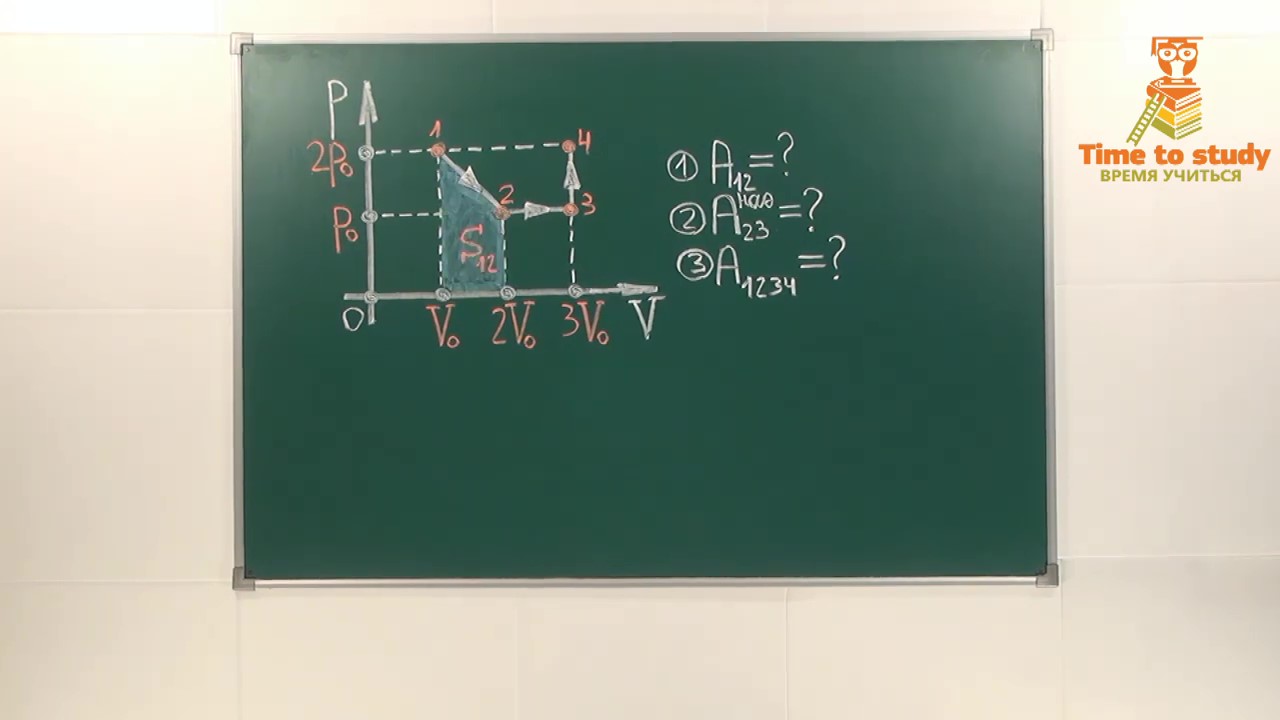
Рисунок 4…………………………………………………….

Фото документ 1…………………………………………………….

Рисунок 5…………………………………………………….

Рисунок 6…………………………………………………….

Рисунок 7…………………………………………………….

Рисунок 8 …………………………………………………….

|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|