
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Основные понятия и определения термодинамики
ТЕХНИЧЕСКАЯ ТЕРМОДИНАМИКА
Термодинамика является научным фундаментом всей современной энергетики, в том числе всех поршневых и реактивных двигателей, паровых и газовых турбин, холодильной и компрессорной техники. Основные законы термодинамики позволяют составить энергетические балансы любых процессов и выявить закономерности взаимопревращений различных видов энергии в любых явлениях природы. Термодинамика занимается поведением макроскопических, т.е. состоящих из большого числа элементов систем, которые можно охарактеризовать термодинамическими параметрами, в частности температурой.
Термодинамика – это наука об энергии, её свойствах и взаимопревращениях различных видов энергии (тепловой, механической и др.), базирующаяся на трёх основных законах:
- первый закон термодинамики – закон сохранения и превращения энергии применительно к термодинамическим процессам;
- второй закон термодинамики, характеризующий направление протекания реальных термодинамических процессов и условия превращения теплоты в работу и состоящий из двух принципов: существования энтропии и её возрастания (закон рассеяния (обесценивания) энергии);
- третий закон термодинамики, объясняющий поведение термодинамических систем при абсолютной температуре, стремящейся к нулю, и часто формулирующийся как принцип недостижимости абсолютного нуля температур (закон неисчерпаемости энергии).
Основным принципом термодинамики является принцип температуры – два тела, находящиеся в тепловом равновесии, имеют одну и ту же температуру.
Условно термодинамика подразделяется на техническую, изучающую законы взаимопревращения теплоты и механической работы применительно к тепловым двигателям и машинам, химическую, изучающую законы взаимопревращения различных видов энергии при изменении химического состава тел, и физическую (общую), изучающую свойства твёрдых, жидких и газообразных тел, электрические и магнитные явления и излучение на основе общих термодинамических положений.
Методы термодинамики применимы только к термодинамическим системам, состоящим из большого числа частиц, и неприменимы к системам бесконечно малых (например, микро- и наноструктурам, состоящим из ограниченного числа атомов) и бесконечно больших размеров (например, Вселенная). Исходные положения термодинамики устанавливаются для термодинамических систем конечных размеров с большим количеством частиц и в этом смысле имеют ограничения как сверху, так и снизу.
При решении задач в термодинамике применяются два метода: метод круговых процессов и метод термодинамических потенциалов. Метод круговых процессов состоит в том, что для изучения какого-либо явления подбирается подходящий обратимый цикл, к которому применимы 1-й и 2-й законы термодинамики, и определяются входящие в них величины. Этот метод используется для расчёта идеальных циклов поршневых и реактивных двигателей. Метод термодинамических потенциалов основан на использовании объединённых выражений для первого и второго законов термодинамики, которые при определённых условиях сопряжения системы с окружающей средой позволяют ввести функции состояния – термодинамические потенциалы, обладающие особыми свойствами. Этот метод используется для расчёта термодинамических свойств химически реагирующих систем при переходе их в равновесное состояние применительно к расчёту параметров жидкостных ракетных двигателей.
Основные понятия и определения термодинамики
- Формы движения материи, виды энергии, работа и теплота.
Существуют различные формы движения материи: механическая, тепловая, химическая, электромагнитная и др. Механическая форма состоит в изменении пространственного расположения макроскопических тел, а тепловая форма представляет собой хаотическое механическое движение большой совокупности микрочастиц, составляющих макроскопические тела. При передаче движения от одних тел к другим уменьшение движения рассматриваемой формы в одном теле сопровождается эквивалентным увеличением движения той же или иной формы в другом теле – согласно принципам сохранения и превращения движения. В случае изменения формы движения наблюдается их количественная эквивалентность.
Количественной мерой для всех форм движения материи, способных превращаться одна в другую, является энергия. Существует множество видов энергии: кинетическая, химическая, тепловая, гравитационная, электрическая и др. Передача движения от одних тел к другим происходит в результате взаимодействия этих тел. При передаче движения материи с превращением его форм энергия не может быть ни уничтожена, ни создана.
В термодинамике все способы обмена энергией (виды термодинамического взаимодействия) можно свести к двум принципиально различным механизмам: совершению работы и теплообмену.
Работа – передача энергии в результате макроскопического, упорядоченного, организованного и направленного движения тел. Количество передаваемой при этом энергии называют работой процесса или просто работой. Работа является функцией процесса, т.к. зависит от пути, по которому протекает процесс. Это макроскопическая форма передачи энергии. Различают следующие виды работ:
- механическая работа, совершаемая механической силой по перемещению тел в пространстве;
- работы немеханического характера (электрическая работа перемещения заряда в электрическом поле, магнитная работа, химическая работа и др.).
Теплообмен – передача энергии под воздействием хаотического теплового движения микрочастиц, составляющих макроскопические тела, при наличии разности температур взаимодействующих между собой тел. В этом случае количество передаваемой энергией называется теплотой процесса или просто теплотой. Теплота, как и работа, является функцией процесса, т.к. зависит от пути его реализации. Это микроскопическая форма передачи энергии.
Следует иметь в виду, что работа и теплота не являются энергией или её видом, а являются лишь двумя способами передачи энергии – способами обмена энергией. Они могут вызывать во взаимодействующих телах изменение движения материи любой формы.
- Термодинамическая система.
Термодинамическая система (ТС) – совокупность тел, обменивающихся между собой и окружающей средой энергией и веществом. Тела, не входящие в состав ТС, объединяются общим понятием «окружающая среда». На границе ТС и окружающей среды происходит взаимодействие между ними, заключающееся в передаче энергии и вещества в ТС и из неё. Число воздействующих на ТС сил определяется числом степеней свободы ТС (N).
Если на ТС воздействуют только силы нормального давления (p) и температуры (T), то число степеней свободы ТС равно двум (N=2); такая система называется простой или термодиформационной. Примером такой ТС может служить рабочее тело в цилиндре поршневого двигателя. Если число степеней свободы больше двух (N>2), то такие ТС называются сложными. Например, если кроме давления и температуры на ТС воздействуют электрическое и магнитное поля, то N=4.
В зависимости от характера взаимодействия между ТС и окружающей средой (т.е. в зависимости от свойств границы между ними) различают:
- закрытые или замкнутые термодинамические системы, если граница ТС непроницаема для вещества, т.е. отсутствует массообмен между ТС и окружающей средой;
- открытые термодинамические системы, если имеется массообмен между ТС и окружающей средой через и границу ТС переходит вещество;
- проточные термодинамические системы, как частный случай открытых ТС, когда на одних участках границы вещество входит в ТС, а на других участках границы выходит из ТС;
- изолированные ТС, когда границу системы не пересекают ни потоки вещества, ни потоки энергии:
- адиабатные ТС, когда система не обменивается с окружающей средой теплотой, т.е. термодинамическая система находится в тепловой изоляции.
В термодинамике обычно рассматриваются неподвижные макроскопические ТС в системе координат, связанной с центром масс ТС.
- Вещество. Фазы. Агрегатные состояния.
Под веществом понимается материя, обладающая массой покоя. Чистое вещество – это вещество, состоящее из одинаковых структурных частиц, т.е. из частиц одинакового вида. При этом под частицами понимаются молекулы, атомы, положительные или отрицательные ионы, электроны. Индивидуальным веществом называется чистое вещество в определённом фазовом состоянии (например C: графит, алмаз или газ).
Тела могут находиться в различных агрегатных состояниях: твёрдом (т), жидком (ж) и газообразном (г). Плазма с точки зрения термодинамики – это ионизированный газ со специфическими свойствами. Пар – это газ, контактирующий со своей конденсированной фазой, и деление на пар и газ является условным.
Фаза – это гомогенная часть гетерогенной ТС, ограниченная поверхностью раздела. Гетерогенная ТС – это система, состоящая из двух и более фаз. Гомогенная ТС – это система, между любыми частями которой нет поверхностей раздела. Конденсированная ТС – это система, состоящая только из твёрдых и жидких фаз. Многокомпонентная ТС – это система, состоящая из двух и более индивидуальных веществ (компонентов ТС). Такими ТС являются растворы, сплавы, смеси. Если в фазе находится несколько газообразных веществ, то это газовая смесь.
- Состояние термодинамической системы. Параметры и функции состояния.
Под термодинамическим состоянием системы понимается распределение и её энергетических характеристик по объёму системы. Состояние рассматриваемой ТС определяется совокупностью физических величин, характеризующих данную ТС. По измерениям этих величин можно проследить за изменениями в ТС при её взаимодействии с окружающей средой.
Состояние ТС является равновесным, если в ТС наблюдается равномерное распределение физических величин. Например, для простых ТС во всех её точках должны быть одинаковыми температура и давление. Если в ТС идут процессы выравнивания неравномерностей физических величин, то состояние системы является неравновесным. Состояние ТС изменяется в результате обмена энергий и массой между ТС и окружающей средой.
Параметрами и функциями состояния ТС называют физические величины, значения которых не зависят от пути, по которому ТС пришла в данное состояние, т.е. от предыстории ТС. К параметрам состояния относятся величины, которые имеют простую физическую природу и могут быть непосредственно измерены: температура (T), давление (p), плотность (ρ), удельный объём (v). Эти параметры выражают интенсивные свойства ТС. Функции состояния имеют сложную физическую природу и не могут быть непосредственно измерены. К ним относятся: внутренняя энергия (U), энтальпия (H), энтропия (S) и ряд других величин.
При взаимодействии ТС с окружающей средой на неё действуют термодинамические силы, которые называются потенциалами термодинамических воздействий или обобщёнными силами. К ним относятся механические силы: давление (p, Па), касательное напряжение (pτ, Па), сила (F, Н) – а также обобщённые силы немеханического характера: температура (T, К), напряжённость магнитного поля (H, А/м), напряжённость электрического поля (E, В/м).
Каждой обобщённой силе соответствует обобщённая координата. Обобщёнными координатами называются параметры состояния, изменяющиеся при наличии взаимодействия данного рода. Например, для простой ТС обобщённой силе – давлению соответствует обобщённая координата – объём, поскольку перемещение поршня приводит к изменению объёма. Для обобщённой силы – температуры роль обобщённой координаты выполняет энтропия (S, Дж/К).
Различие значений обобщённой силы на границе между ТС и окружающей средой приводит к взаимодействию данного рода, т.е. передаче энергии в данной форме. Это необходимое условие возникновения в ТС различных процессов: теплообмена и различных видов работы.
Все физические величины, характеризующие ТС, подразделяются на независимые, которые задаются, и зависимые, которые вычисляются через известные параметры, а также на калорические и термические, интенсивные и экстенсивные, полные и относительные.
Калорические величины – это величины, которые выражаются в единицах энергии. Например, внутренняя энергия (U, Дж), энтропия (S, Дж/К), теплота (Q, Дж), работа (L, Дж), теплоёмкость (C, Дж/К) и др. Термические величины – это величины, чей физический смысл не связан непосредственно с понятием энергии. Например: термодинамическая температура (T, К), давление (p, Па) и др.
Параметры, не зависящие от количества вещества ТС, выражают интенсивные свойства ТС. К ним относятся:
1. Термодинамическая температура (T, К) по абсолютной термодинамической шкале температур Кельвина, которая связана с эмпирической шкалой температур Цельсия (стоградусной международной температурной шкалой) формулой: 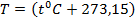 К.
К.
2. Термодинамическое абсолютное давление 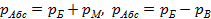 , Па, где
, Па, где 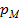 – манометрическое (избыточное) давление, измеряемое манометром;
– манометрическое (избыточное) давление, измеряемое манометром; 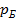 – барометрическое (атмосферное) давление, измеряемое барометром;
– барометрическое (атмосферное) давление, измеряемое барометром; 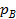 – давление, измеряемое вакуумметром (избыток барометрического давления над абсолютным давлением). Согласно Международной системе единиц СИ давление имеет единицу величины Н/м2 и называется паскаль (Па), но допускаются и внесистемные единицы давления: техническая атмосфера (ат); избыточная техническая атмосфера (ати); абсолютная техническая атмосфера (ата); физическая атмосфера (ат) – давление атмосферного воздуха на уровне моря; бар (бар); миллиметры ртутного (мм. рт. ст) или водяного (мм. вот. ст.).
– давление, измеряемое вакуумметром (избыток барометрического давления над абсолютным давлением). Согласно Международной системе единиц СИ давление имеет единицу величины Н/м2 и называется паскаль (Па), но допускаются и внесистемные единицы давления: техническая атмосфера (ат); избыточная техническая атмосфера (ати); абсолютная техническая атмосфера (ата); физическая атмосфера (ат) – давление атмосферного воздуха на уровне моря; бар (бар); миллиметры ртутного (мм. рт. ст) или водяного (мм. вот. ст.).
Численные соотношения между различными единицами измерения давления следующие:
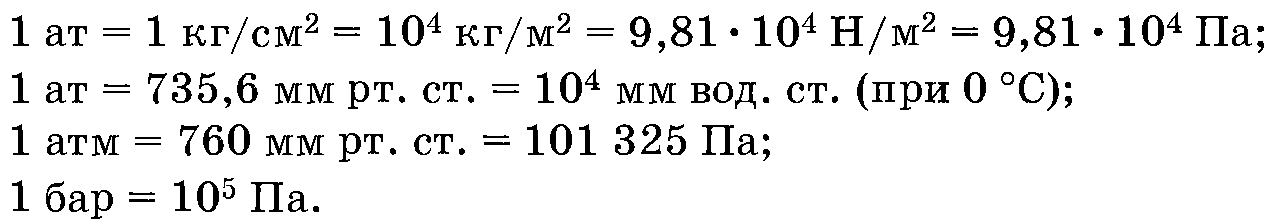
3. Удельный объём рабочего тела 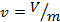 , м3/кг, где
, м3/кг, где 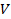 , м3 – объём ТС;
, м3 – объём ТС; 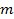 , кг – масса ТС.
, кг – масса ТС.
4. Плотность – масса единицы объёма рабочего тела или массовая концентрация 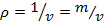 , кг/м3.
, кг/м3.
К параметрам, выражающим интенсивные свойства ТС, относятся также напряжённости электрического и магнитного полей и др.
Экстенсивными или аддитивными (суммируемыми) параметрами называются величины, значения которых пропорциональны количеству вещества ТС. К ним относятся внутренняя энергия (U), энтальпия (H), объём (V), энтропия (S) и др. Эти величины также называются полными для заданной массы ТС. Если ТС состоит из отдельных частей, то значение экстенсивной величины для ТС равно сумме значений этой величины для всех частей ТС.
Для гомогенной однородной ТС удобно использовать относительные величины:
1. Удельные величины, отнесённые к 1 кг вещества. Например: 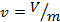 – удельный объём, м3/кг;
– удельный объём, м3/кг; 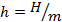 – удельная энтальпия, Дж/кг;
– удельная энтальпия, Дж/кг; 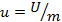 – удельная внутренняя энергия, Дж/кг;
– удельная внутренняя энергия, Дж/кг; 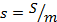 – удельная энтропия, Дж/кг·К и др.
– удельная энтропия, Дж/кг·К и др.
2. Объёмные величины, отнесённые к 1 м3 вещества: ρ – массовая концентрация, кг/м3.
3. Молярные величины, отнесённые к 1 молю вещества: 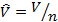 – молярный объём, м3/моль, где n – количества вещества, моль;
– молярный объём, м3/моль, где n – количества вещества, моль; 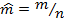 – молярная масса, кг/моль;
– молярная масса, кг/моль; 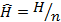 – молярная энтальпия, Дж/моль;
– молярная энтальпия, Дж/моль; 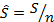 – молярная энтропия, Дж/(моль·К);
– молярная энтропия, Дж/(моль·К); 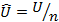 – молярная внутренняя энергия, Дж/моль.
– молярная внутренняя энергия, Дж/моль.
Молем газа называется количество газа, весящего столько граммов, сколько единиц в относительной молекулярной массе M: m=M·10-3 кг/моль. В одном моле любого вещества содержится NA=6,022·1023 [1/моль] частиц (молекул) газа, где NA – число (постоянная) Авогадро. В соответствии с законом Авогадро в равных объёмах разных газов при одинаковых давлениях и температурах содержится равное число молекул.
Для характеристики масс частиц вещества будем использовать следующие величины:
1. Молекулярная масса – масса одной структурной частицы (m1, кг).
2. Относительная молекулярная масса M=m1/ ((1/12)·m12c) – безразмерная величина, приводимая в таблицах для каждого индивидуального вещества в справочниках.
3. Молярная масса – масса одного моля вещества m=m1NA=m/n= M·10-3, кг/моль.
Конец.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|