
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Опыты Резерфорда
Строение атома. Модель Томсона .
Опыты Резерфорда
Открытие сложного строения атома — важнейший этап становления современной физики, наложивший отпечаток на все ее дальнейшее развитие. В процессе создания количественной теории строения атома, позволившей объяснить атомные спектры, были открыты новые законы движения микрочастиц — законы квантовой механики.
Долгое время, физика накапливала факты о свойстве вещества для полного представления о строении атома. И только в XIX веке изучение атомического строения вещества существенно сдвинулось с точки покоя.
Большую роль в развитии атомистической теории сыграл выдающийся русский химик Дмитрий Иванович Менделеев, разработавший в 1869 году периодическую систему элементов, в которой впервые был поставлен вопрос о единой природе атомов.
Важным свидетельством сложной структуры атомов явились исследования спектров, излучаемые веществом, которые привели к открытию линейчатых спектров атомов. В начале XIX века в излучении атома водорода были открыты спектральные линии в видимой части спектра.
Модель Томсона
Модель атома Томсона называют «пудингом с изюмом». Используя эту модель, можно было объяснить электрическую проводимость веществ, явление электризации тел и др.
Первая модель атома была предложена английским физиком Дж. Дж. Томсоном, открывшим электрон. По мысли Томсона, положительный заряд атома занимает весь объем атома и распределен в этом объеме с постоянной плотностью. Простейший атом (атом водорода) представляет собой положительно заряженный шар радиусом около 10-8 см, внутри которого находится электрон. У более сложных атомов в положительно заряженном шаре находится несколько электронов, так что атом подобен кексу, в котором роль изюминок выполняют электроны. Однако модель атома Томсона оказалась в полном противоречии с известными уже к тому времени свойствами атома, главным из которых является устойчивость.
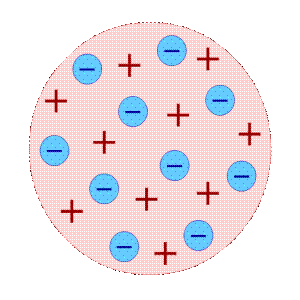

Таким образом, к началу XX века учёные сделали вывод о том, что атомы материи имеют сложную внутреннюю структуру. Они являются электрически нейтральными системами, а носителями отрицательного заряда атомов являются лёгкие электроны, масса которых составляет лишь малую долю массы атомов. Однако модель атома Томсона находилась в полном противоречии с экспериментами по изучению распределения положительных зарядов.
Электрон – наименьшая электроотрицательная заряжённая элементарная частица
Масса покоя электрона me = 9,1·10-31кг;
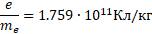 - отношение заряда электрона к его массе.
- отношение заряда электрона к его массе.
Немецкий физик Филипп фон Ленард в 1903 году проводил опыты, в которых пучок быстрых электронов легко проходил через тонкую металлическую фольгу. На основании этого Ленард предположил, что атом состоит из нейтральных частиц или нейтральных дуплетов с совмещённым положительным и отрицательным зарядами, рассредоточенными в атоме, где большая площадь представляет собой пустоту.
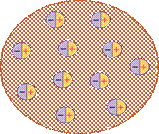
В 1904 году японский физик Хентаро Нагаока выдвинул гипотезу о том, что атом состоит из тяжелого положительно заряженного ядра, окруженного кольцами из большого числа электронов, колебания которых и являются причиной испускания атомных спектров, по аналогии с теорией устойчивости колец Сатурна.
 Но в физике уже более 200 лет существует главное правило: окончательный выбор между гипотезами может быть сделан только на основе опыта. Эксперименты, проведенные в первый раз Эрнестом Резерфордом, сыграли решающую роль в понимании структуры атома.
Но в физике уже более 200 лет существует главное правило: окончательный выбор между гипотезами может быть сделан только на основе опыта. Эксперименты, проведенные в первый раз Эрнестом Резерфордом, сыграли решающую роль в понимании структуры атома.
 30.08.1871 г. – 19.10.1937 г.
30.08.1871 г. – 19.10.1937 г.
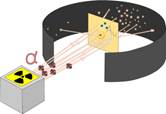

Проводя опыты по изучению строения вещества, Резерфорд показал несостоятельность модели Томсона. Резерфорд облучал тонкую металлическую фольгу α-частицами, имеющими большую энергию. В соответствии с моделью Томсона а-частицы должны были отражаться от атома. Однако очень небольшое число частиц рассеивалось на углы от 90° до 180°. Большинство частиц проходило через фольгу, отклоняясь от направления движения на незначительные углы.
В результате экспериментов Резерфорд предложил новую модель строения атома, названную планетарной моделью. Он сделал следующие выводы:
· в атоме существует положительно заряженная частица, названная ядром атома, которая отталкивает α-частицы;
· размеры ядра малы по сравнению с размерами атома, поскольку отталкивается очень небольшое число α-частиц, а большинство α-частиц свободно проходит через фольгу; ядро имеет диаметр порядка 10–14 — 10–15 м.
· масса ядра сравнима с массой β-частицы, поскольку масса электронов в 8000 раз меньше массы а-частицы и электроны не смогли бы изменить направление её движения.
Таким образом, в соответствии с моделью атома Резерфорда в центре атома расположено положительное ядро, вокруг которого движутся отрицательно заряженные электроны. Электроны движутся вокруг ядра, подобно тому как планеты обращаются вокруг Солнца. Поскольку масса электронов мала, то масса атома в основном сосредоточена в ядре.
Так как атом в целом нейтрален, то положительный заряд ядра должен быть равен суммарному заряду электронов. Число электронов в нейтральном атоме равно порядковому номеру Z элемента в периодической системе Д.И. Менделеева. Заряд атомного ядра qR равен произведению Z и заряда электрона е: qR= Z • е.
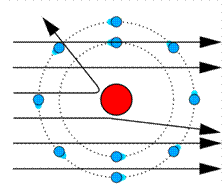
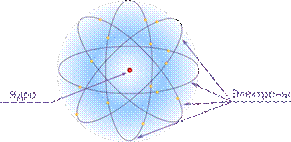
Таким образом, на основе планетарной модели можно было объяснить результаты опытов по рассеянию альфа — частиц. Однако объяснить стабильность атомов не удавалось. Движение электрона в атоме происходит с ускорением. В соответствии с классической электродинамикой это движение должно было сопровождаться излучением электромагнитных волн, в результате чего энергия электрона в атоме непрерывно уменьшалась бы. Электрон стал бы приближаться к ядру по спирали и должен был бы очень скоро упасть на него. Однако атомы стабильны. Следовательно, планетарная модель противоречила законам классической физики.
Но на основе этой модели нельзя объяснить факт существования атома, его устойчивость. Ведь движение электронов по орбитам происходит с ускорением. Ускоренно движущийся заряд должен излучать электромагнитные волны с частотой, равной частоте его обращения вокруг ядра. Электроны должны приближаться к ядру, подобно тому как спутник приближается к Земле при торможении в верхних слоях атмосферы. Атом должен прекратить свое существование. В действительности ничего подобного не происходит. Атомы устойчивы и в невозбужденном состоянии могут существовать неограниченно долго, совершенно не излучая электромагнитные волны
В начале XX века было уже известно, что вещество излучает свет конкретных длин волн в определенных, очень узких спектральных интервалах - спектральных линиях, все линии имеют конечную длину.
Линейчатые спектры дают все вещества в газообразном атомарном (но не молекулярном состоянии). Классическим примером линейчатого спектра является спектр атома водорода.
Швейцарский физик и математикИоганн Якоб Бальмер определил, что в видимой части спектра атома водорода имеются четыре линии, соответствующие длинам волн: λ1 = 434 нм; λ2 = 486 нм; λ3 = 410 нм; λ4 = 656 нм
Частота излучений атома водорода составляет ряд серий, каждая из которых образуется в процессе перехода атома в одно из энергетических состояний, переходов электрона с верхних энергетических уровней на нижние уровни.
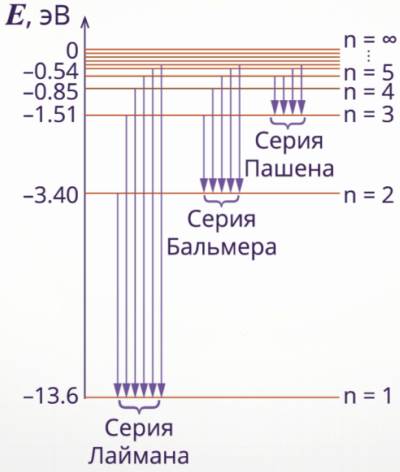
На рисунке можно увидеть переходы электрона на другой энергетический уровень, частоты излучения которого находятся в видимой области спектра.
Не согласующийся с опытом вывод о неизбежной гибели атома вследствие потери энергии на излучение — это результат применения законов классической физики к явлениям, происходящим внутри атома. Отсюда следует, что к таким явлениям законы классической физики неприменимы. Все выводы об устойчивости атома и спектре, которые излучает атом будут подтверждены Нильсом Бором в 1913 году.
Первый постулат Бора
Cуществуют особые, станционарные состояния атома, находясь в которых атом не излучает энергию, при этом электроны в атоме движутся с укорением. Каждому стационарному состоянию соответствует определенная энергия Еn.
Bторой постулат Бора
Излучение света происходит при переходе атома из стационарного состояния с большей энергией Ek в стационарное состояние с меньшей энергией Еn.
Энергия излученного фотона равна разности энергий стационарных состояний:
hv = Еk - Еn
Большую часть времени электрон находится на определенном расстоянии от ядра. Это расстояние можно принять за грубое подобие радиуса орбиты. Фотография атома совсем не походила бы на привычный рисунок Солнечной системы, а скорее напоминала бы расплывчатое пятно, полученное при фотографировании бабочки, порхающей около фонаря. В настоящее время с помощью квантовой механики можно ответить практически на любой вопрос, относящийся к строению и свойствам электронных оболочек атомов.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|