
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Изотопы – ядра с одинаковым числом p, но разным числом n
СТРОЕНИЕ АТОМА
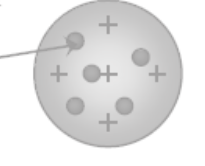
1.Модель атома Дж. Томсона – 1903 г
 1897 г. – открытие электрона e -
1897 г. – открытие электрона e -
e -
«КЕКС с изюмом»
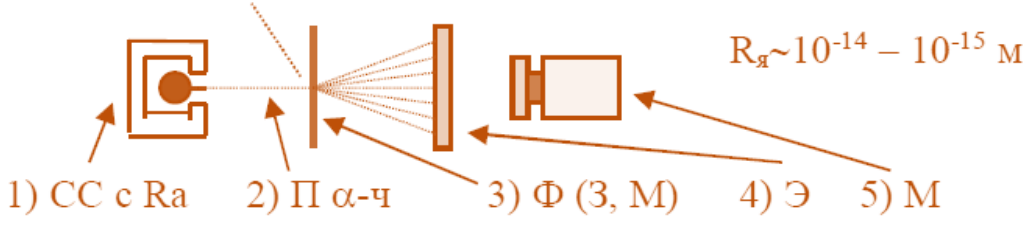
2.Опыт Э. Резерфорда – 1911 г
 ?
?
«Снаряды» - α – частицы. На экране – вспышки (сцинтилляции)!
 qα = +2e
qα = +2e
mα = 8000me
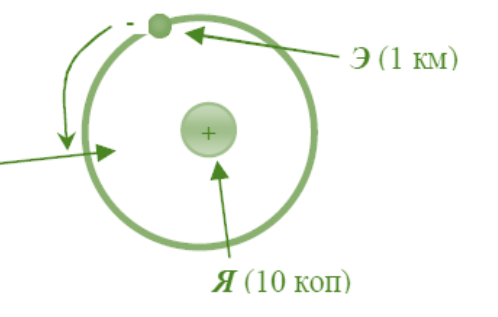
3. Планетарная модель атома
o атом – ядро + электроны
o масса ядра – 99%
o ядро d = 10-15 м, атом d= 10-10 м
o заряд ядра qЯ = +Ne (атом нейтрален!)
4.
5. Строение атомного ядра – 1932г (Иваненко и Гейзенберг)
Ядро = Нуклоны = Протоны + Нейтроны A = N + Z Атомная масса

 A –массовое число (число нуклонов)
A –массовое число (число нуклонов)
Z –зарядовое число (число протонов)
N – число нейтронов (N = A – Z)
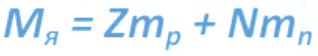
mp≈mn≈1 а.е.м. Порядковый номер
qp=+е; qn=0; qЯ = +Ze
6. Изотопы – ядра с одинаковым числом p, но разным числом n
Изотопы водорода:  – протий;
– протий; 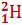 – дейтерий;
– дейтерий; 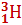 - тритий
- тритий
Имеются у всех элементов
(хим. свойства одинаковы, физ. свойства различны)
1.Открытие протона –1919г. – Э.Резерфорд
GF
6H + I_ J
H → 'K
6G + I 6
6 (протон) − L 6
2.Открытие нейтрона –1932г. – Дж.Чедвик
M_ H
N + I_ J
H → O + P(нейтрон) 7
Q
6J
Нейтрон:- нестабильная частица (P → L + _ + нейтрино) − 15мин
- q отсутствует
- _ = 2,5__
- не ионизирует воздух
- «могучее оружие» для ядерных реакций
GF
6H + P 7
6 → SM
66 + I_ J
H
Примеры: Применение в медицине:
1.Кислород – 3 1.Исследование обмена веществ
2.Свинец – 10 2.Исследование кровообращения
3.Уран – 10 3.Лечение базедовой болезни
4. Водород - 3 4.Лечение раковых заболеваний
qя = Nqp
T U 8 G
Получают в атомных реакторах и на ускорителях
В конце 19 в. – атомы вещества имеют …
1903 г. Томсон: атом представляет собой … (Ra10-10 м)
1911 г. Резерфорд – ПМА!
AX
Z – обозначение ХЭ
А– МЧ: равно…, 12 0
1а.е.м. 1 m 12С
Z– ЗЧ: равно…
Содди и Резерфорд: Ra Rn!
При радиоактивных превращениях изменения претерпевает …
→
+
Ядра атомов имеют СС !
ПРЧ –устройство для… ( система в НС)
Пролёт частицы – переход в УС! (Ионизация атомов вещества!)
МС– …(Резерфорд) СГ –е и
КВ– ЗЗЧ, q, m, E
Э (1 км)
Я (10 коп)
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|