
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
При взаимодействии с металлами никогда не выделяется водород
При взаимодействии с металлами никогда не выделяется водород
HNO3 + Me = соль + H2O + Х
| Щелочные и щелочноземельные | Fe, Cr, Al, Ni, Co | Металлы до водорода | Металлы после водорода (Cu и др) | Благородные Au, Pt, Os, Ir, Ta | |
| HNO3 (конц.ω>60%) | N2O | пассивация (при обычных условиях); NO2 (при нагревании) | NO2 | NO2 | Нет реакции |
| HNO3 (разбавл.) | NH3, NH4NO3 | Основной NO, но в зависимости от разбавления могут образовываться N2, N2O, NH3, NH4NO3. Чем больше разбавлена кислота, тем ниже степень окисления азота. | NO | ||
Таблица. Продукты реакции взаимодействия азотной кислоты с металлами
Концентрированная серная кислота является сильным окислителем; при взаимодействии с металлами (кроме Au, Pt) восстанавливаться до S+4O2, S0 или H2S-2 в зависимости от активности металла. Без нагревания не реагирует с Fe, Al, Cr – пассивация. При взаимодействии с металлами, обладающими переменной валентностью, последние окисляются до более высоких степеней окисления, чем в случае с разбавленным раствором кислоты: Fe0 → Fe3+, Cr0→ Cr3+, Mn0→Mn4+,Sn0→ Sn4+
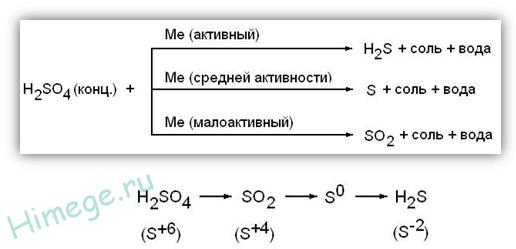
Активный металл
8 Al + 15 H2SO4(конц.)→4Al2(SO4)3 + 12H2O + 3H2S
4│2Al0 – 6e— → 2Al3+ — окисление
3│ S6+ + 8e → S2– восстановление
4Mg+ 5H2SO4 → 4MgSO4 + H2S + 4H2O
Металл средней активности
2Cr + 4 H2SO4(конц.)→ Cr2(SO4)3 + 4 H2O + S
1│ 2Cr0 – 6e →2Cr3+— окисление
1│ S6+ + 6e → S0 – восстановление
Металл малоактивный
2Bi + 6H2SO4(конц.)→ Bi2(SO4)3 + 6H2O + 3SO2
1│ 2Bi0 – 6e → 2Bi3+ – окисление
3│ S6+ + 2e →S4+ — восстановление
2Ag + 2H2SO4 →Ag2SO4 + SO2 + 2H2O
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|