
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Исследования спектра испускания водорода и определение постоянной Ридберга.
Министерство науки и высшего образования Российской Федерации
Федеральное государственное бюджетное образовательное учреждение высшего образования
«Новгородский государственный университет имени Ярослава Мудрого»
Кафедра «Общей и экспериментальной физики»
Отчет по лабораторной работе № 11
Исследования спектра испускания водорода и определение постоянной Ридберга.
Выполнил: студент гр. 0325
Николаева Анна Витальевна
Проверил: преподаватель каф. ОЭФ
Окунев Алексей Олегович
Великий Новгород
Цель работы: исследование серии Бальмера в видимой области спектра атомарного водорода и определение постоянной Ридберга.
Теория
Изолированные газы в виде разряженного газа или паров металла испускают спектр, состоящий из отдельных спектральных линий разной интенсивности, соответствующих различным длинам волн. В соответствии с этим спектр испускания атомов называется линейчатым.
Швейцарский ученый И.Бальмер в результате длительного изучения линейчатого спектра атомарного водорода установил закономерности в расположении линий в видимой области спектра. В настоящее время в спектре водорода наблюдается 6 серий, которые описываются формулой
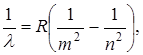 (11.1)
(11.1)
где λ – длина волны соответствующей линии, R=1,097.107 м-1 – постоянная Ридберга, m и n – целые числа, причем n принимает значения, начиная с m+1.
m определяет спектральную серию: m=1 – серия Лаймана, m=2 – серия Бальмера, m=3 – серия Пашена, m=4 – серия Брекетта, m=5 – серия Пфунда, m=6 – серия Хемфри.
Попытки построить модель атома, которая смогла бы объяснить возникновение спектров испускания, были предприняты Томсоном (1903 г.), Резерфордом (1913 г.) и потерпели неудачу.
Первая попытка построения неклассической теории атома была предпринята Н.Бором в 1913 г.
Первый постулат Бора (постулат стационарных состояний) заключается в следующем: из бесконечного множества электронных орбит, возможных с точки зрения классической механики, осуществляются только некоторые дискретные орбиты, удовлетворяющие определенным квантовым состояниям, энергии которых составляют дискретный ряд: W1 ,W2,W3,...В стационарном состоянии атом не излучает.
Второй постулат Бора(правила квантования орбит): в стационарном состоянии атома электрон движется только по таким орбитам, для которых момент импульса электрона удовлетворяет условию:
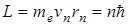 , (11.2)
, (11.2)
где ħ – постоянная Планка, равная 1,054.10-34 Дж.с; n=1,2,3,…; me – масса электрона; rn – радиус соответствующей орбиты.; vn – скорость электрона.
Третий постулат Бора(правило частот): при переходе атома из одного стационарного состояния в другое испускается или поглощается один квант энергии.
Излучение происходит при переходе из состояния с большей энергией в состояние с меньшей энергией, т.е. при переходе электрона с орбиты, более удаленной от ядра, на более ближнюю к ядру:
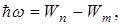 (11.3)
(11.3)
где 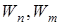 – энергия электрона на соответствующей орбите;
– энергия электрона на соответствующей орбите; 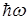 – квант энергии;
– квант энергии; 
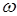 – циклическая частота излучения.
– циклическая частота излучения.
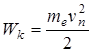 потенциальная энергии взаимодействия электрона с ядром
потенциальная энергии взаимодействия электрона с ядром 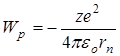 ,
,
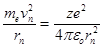
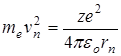 ,
,
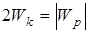 - потенциальная энергия
- потенциальная энергия
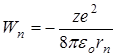
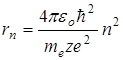 -радиус орбиты
-радиус орбиты
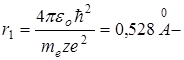 радиус первой Боровской орбиты.
радиус первой Боровской орбиты.
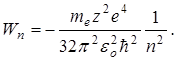
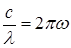 -длинна волны
-длинна волны
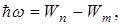 =>
=> 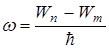
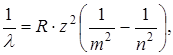 - обобщенную формулу Бальмера
- обобщенную формулу Бальмера
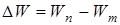 - квант энергии
- квант энергии
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|