
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Оксид меди (II).. Химические свойства
СuОН
Гидроксид меди(I) — неорганическое соединение, гидроксид металла меди с формулой CuOH, жёлтое вещество, не растворяется в воде. Неустойчив, легко разлагается:
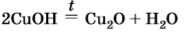
Получается при окислении альдегидов гидроксидом меди (II) при нагревании:
СН3СОН + 2Сu(ОН)2 (t)→СН3СООН + 2СuОН↓+Н2О
2СuОН(t)→Сu2О +Н2О
Оксид меди (II).
 Получение:
Получение:
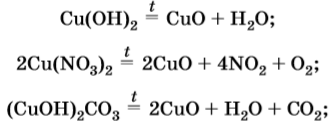
Химические свойства
1.Преобладают основные свойства:
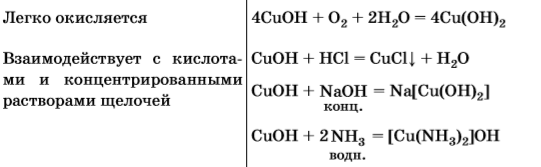
взаимодействует
а) с кислотными оксидами;
б) с кислотами- неокислителями и кислотами окислителями с получением солей меди (II). Это реакции обмена, не ОВР, так как степень окисления +2 стабильная
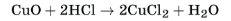
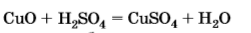
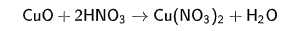
!!! 2.Слабые амфотерные свойства, которые проявляются только при сплавлении со щелочами, образуя купраты:
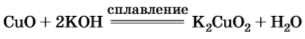
!!!3.Взаимодействие с аммиаком:
Если газообразный аммиак пропускают над оксидом меди (II), то медь восстанавливается: 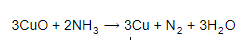
В водных растворах аммиака образуется комплексная соль:
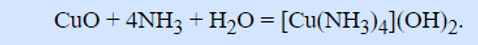
4. Окислительные свойства:

Сu(ОН)2
 Получение:
Получение:
Взаимодействие растворимых солей со щелочами: 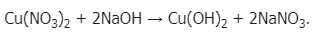
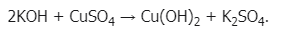
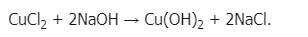
Свойства:

1.Взаимодействует с кислотами:
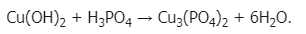
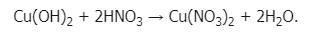
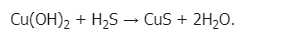
2. Как и все нерастворимые основания, гидроксид меди (II) при нагревании разлагается на оксид и воду, в данном случае образуется оксид меди (II):
Cu(OH)2 →to CuO + H2O
!!!!!При длительном стоянии на воздухе, обогащённом кислородом, гидроксид меди (II) вступает в обратимую реакцию с кислородом, образуя грязно-красный оксид меди (III):
4Cu(OH)2 + O2 ⇄ 2Cu2O3↓ + 2H2O
Равновесие в этой реакции сдвинуто влево.
При избытке влаги может образоваться гидроксид куприла (III):
4Cu(OH)2 + O2 → 4CuO(OH)↓ + H2O
Очень легко растворяется в избытке аммиака с образованием дигидроксотетрааммиаката меди:
Cu(OH)2 + 4NH3 ⋅ H2O → [Cu(NH3)4](OH)2 + 4H2O
или
Cu(OH)2 + 4NH3 → [Cu(NH3)4](OH)2
Аммиакат меди имеет интенсивный сине-фиолетовый цвет, поэтому его используют в аналитической химии для определения малых количеств ионов Cu2+ в растворе.
С разбавленными растворами щелочей не реагирует, в концентрированных растворяется, образуя ярко-синие тетрагидроксокупраты (II):
Cu(OH)2 + 2NaOH → Na2[Cu(OH)4]
Соли меди:


СuCl2

в) Галогениды CuF, CuСl, CuBr и CuJ
Все эти соединения – белые кристаллические вещества, плохо растворимые в воде, но хорошо растворимые в избытке NH3, цианидных ионов, тиосульфатных ионов и иных сильных комплексообразователей. Иод образует только соединение Cu+1I. В газообразном состоянии образуются циклы типа (CuГ)3 [10]. Обратимо растворимы в соответствующих галогенводородных кислотах:
CuГ + HГ ↔ H[CuГ2] (Г=Cl, Br, J)
Хлорид и бромид меди (I) неустойчивы во влажном воздухе и постепенно превращаются в основные соли меди (II):
4CuГ +2H2O +O2 →4Cu(OH)Г (Г=Cl, Br)
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|