
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Тема : Расположение электронов в атомах.(Конспект)
Тема : Расположение электронов в атомах.(Конспект)
1. Двигаясь вокруг атома, электроны образуют в совокупности его электронную оболочку.
2. Совокупность всех электронов, окружающих ядро, называется электронной оболочкой (записываем определение)
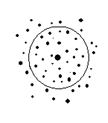
3. Выясним, как движутся электроны вокруг ядра?
4. Электроны в атоме различаются определенной энергией, и, как показывают опыты, одни притягиваются к ядру сильнее, другие слабее. Объясняется это удаленностью электронов от ядра. Чем ближе электроны к ядру, тем больше связь их с ядром, но меньше запас энергии. По мере удаления от ядра атома сила притяжения электрона к ядру уменьшается, а запас энергии увеличивается. Каждый электрон в зависимости от своей энергии будет находиться на определенном расстоянии от ядра. Так образуются электронные слоив электронной оболочке атома.
5. Электронный слой, состоящий из электронов с близкими значениями энергии, называется энергетическим уровнем. ( записываем определение)
6. Как определить , сколько слоев ( энергетических уровней) в атоме того или иного элемента?
7. Число уровней определяется номером периода, в котором располагается элемент.
8. Например:
у Na - 2 энергетических уровня, т.к. он находиться во 2 периоде
у N – 3 энергетических уровня , т.к. он находиться в 3 периоде
у Fe – 4 энергетических уровня , т.к. он находиться в4 периоде
9. Сколько электронов может находиться на каждом энергетическом уровне? Максимальное число электронов, которое может находиться на том или ином энергетическом уровне, определяется по формуле N = 2n2, где N- максимальное число электронов на уровне; n– номер энергетического уровня.
1 энергетический уровень, n=1, N=2∙12 =2
2 энергетический уровень, n=2, N=2∙22=8
3 энергетический уровень, n=3, N=2∙32=18
4 энергетический уровень, n=4, N=2∙42=32
Каждый уровень вмещает не больше рассчитанного количества электронов.
а) Если электронный слой содержит максимально возможное число электронов, то его называют завершенным.
б) Электронные слои, не содержат максимальное число электронов, то называют незавершенными.
10. Электрон движется не по орбите, а по орбитали и не имеет траектории.
Пространство вокруг ядра, где наиболее вероятно нахождение данного электрона, называется орбиталью этого электрона, или электронным облаком.( записываем определение)
11. Орбитали, или подуровни, как их еще называют, могут иметь разную форму, и их количество соответствует номеру уровня, но не превышает четырех. Первый энергетический уровень имеет один подуровень (s), второй- два (s,p), третий – три (s,p,d) и т.д. Электроны, находящиеся на одном энергетическом уровне тоже отличаются друг от друга.
Электроны разных подуровней одного и того же уровня имеют разную форму
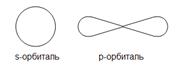
электронного облака: сферическую (s), гантелеобразную (p) и более сложную конфигурацию.
S- орбиталь- это просто шарик. Путь электрона по ней напоминает путь нитки, которую наматывают на клубок. С нее начинается каждый уровень
P – орбиталь похожа на объемную восьмерку или перекрученную сосиску, и вместе перекрутки расположено ядро. Таких орбиталей на каждом энергетическом уровне -3, они располагаются под углом 90 – как оси координат.
D- орбиталь – это две p-орбитали , соединенные центрами – как объемная четырехлепестковая ромашка, их на подуровне может быть 5.
F – орбиталь имеет более сложную форму, ее трудно описать словами.
Представьте путь своей мысли при решении системы уравнений с 3 неизвестными – это примерно такой же сложности.
Каждая орбиталь вмещает максимум 2 электрона с противоположными спинами.
12. Спин- это условное направление движения электрона вокруг своей оси – оно может быть либо по часовой стрелке, либо против. Только электроны с разными спинами уживаются на одной орбитали, т.к. отталкивание их из-за одноименных зарядов частично гасится.
13.  В электронно-графических формулах атомов орбитали ( для удобства записи) обозначают квадратиками. Надо запоммнить, что s –орбиталь, всегда одна - - , p-орбиталей, всегда три -
В электронно-графических формулах атомов орбитали ( для удобства записи) обозначают квадратиками. Надо запоммнить, что s –орбиталь, всегда одна - - , p-орбиталей, всегда три -
 d – орбиталей –пять
d – орбиталей –пять

 f – орбиталей - семь
f – орбиталей - семь
Выводы: а) электроны в атомах располагаются на энергетических уровнях, подуровнях(орбиталях)
б) количество энергетических уровнейв атоме равно номеру периода, энергетические уровни обозначаются арабскими цифрами:1.2.3,....
в) подуровни (орбитали) обозначаются латинскими буквами ( s,p,d,f,), их количество равно номеру эн.уровня, но не больше четырёх. Орбитали рисуют квадратиками (для упрощения).
в) на одной орбитали может располагаться максимум 2-а электрона с разными спинами.
г) электроны обозначаются стрелочками
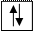 Напр.
Напр.
а) полностью заполненная орбиталь -
 б) наполовину заполненная орбиталь -
б) наполовину заполненная орбиталь -
Напр.
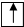

 1s
1s
Энергетический уровень
Подуровень (орбиталь) с электроном.
Энергетические уровни , подуровни (орбитали), электроны.
| Номер энергетичес-кого уровня - n | Подуровни данного уровня | Количество электронов – N, максимум | Всего электро-нов на уровне |
 1s 1s
| 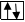 1s 1s
| ||
 2s 2s
 2p 2p
|
 2s 2s
  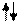  2p 2p
| ||
 3s 3s
 3p 3p
 3d 3d
|
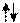  3s 3s
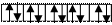  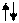 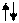  3p
3d 3p
3d
| ||
 4s 4s
 4p 4p
 4d 4d
 4f 4f
| 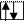 4s 4s
 4p 4p
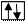 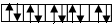 4d 4d
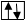   4f 4f
| ||
 5s 5s
 5p 5p
 5d 5d
 5f 5f
| |||
| 6,7 | Все те же орбитали, только уровни 6,7 |
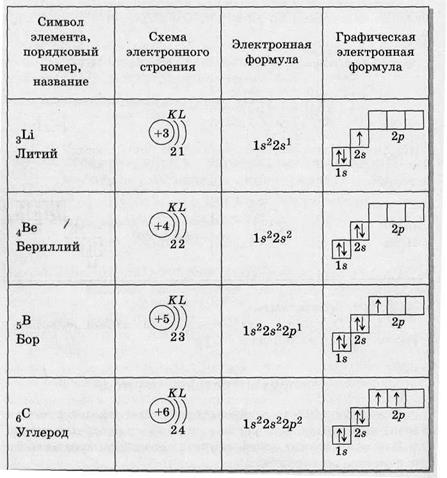
14. Теперь мы можем составить схему строения электронных оболочек атомов:
а) определяем общее число электронов на оболочке по порядковому номеру элемента.
б)определяем число энергетических уровней в электронной оболочке. Их число равно номеру периода в таблице Д. И. Менделеева, в котором находится элемент.
в)определяем число электронов на каждом энергетическом уровне.
в)используя для обозначения уровня арабские цифры и обозначая орбитали буквами s и p, а число электронов данной орбитали арабской цифрой вверху справа над буквой, изображаем строение атомов более полными электронными формулами.
Электронные и электронно-графические формулы атомов – показывают расположение электронов в атомах.
Напр. см. таблицу на стр.5.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|