
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Химическое равновесие и теория электролитической диссоциации в аналитических процессах.
Химическое равновесие и теория электролитической диссоциации в аналитических процессах.
План
1.Общие понятия о растворах и растворимости
2.Способы выражения концентрации растворов
3.Закон действия масс
4.Химическое равновесие
5.Электролитическая диссоциация. Степень диссоциации. Константа диссоциации. Степень диссоциации слабых электролитов.
Все вещества растворимы в воде. Каждое из них характеризуется определенной растворимостью. Растворимость – максимальное количество вещества, которое способно раствориться при данной температуре в определенном количеств растворителя. Растворы – однофазные системы, состоящие из двух или более компонентов. Компоненты растворов сохраняют свои уникальные свойства и не вступают в химические реакции между собой с образованием новых соединений. Компоненты, присутствующие в растворе в большом количестве называют растворителем, остальные компоненты – растворенные вещества. Два вещества растворяющиеся дуг в друге в любых пропорция с образованием истинных растворов называются полностью взаиморастворимыми. (например газы; жидкости – спирт и вода; твердые вещества Ag-Au).
Если два компонента образуют одну фазу при смешивании только в определенных пропорциях, а в других случаях возникают две фазы – то они называются частично взаиморастворяемыми (например: вода-бензол). Растворимость вещества принято выражать в граммах растворенного вещества на 100 г. воды, или в молях на 1 л. раствора.
По агрегатному состоянию растворы делят на :
1. Твердые (латунь – сплав Cu и Zn)
2. Жидкие (морская вода)
3. Газообразные (воздух)
По количеству растворенного вещества растворы делят на:
1. Насыщенные – растворенное вещество содержится в количестве, равном растворимости этого вещества при данной температуре. В насыщенном растворе уже нельзя растворять вещества не изменяя внешних условий (t, p,V), поэтому если в такой раствор добавить еще вещество, оно не раствориться и выпадет в осадок.
2. Ненасыщенные – растворенного вещества содержится в меньшем количестве, чем его растворимость. В ненасыщенном растворе можно растворить еще некоторое количество того же вещества и растворение будет продолжаться пока раствор не станет насыщенным.
3. Перенасыщенные – растворенного вещества содержится больше, чем его растворимость при данной температуре. Если в пересыщенный раствор бросить кристаллик вещества, то вокруг него начнут расти новые кристаллы и кристаллы будут выпадать до тех пор, пока раствор не станет насыщенным.
По содержанию растворенного вещества растворы делят на:
1. Разбавленные – растворенного вещества содержится мало, по сравнению с растворителем и далеко до насыщения.
2. Концентрированные – раствор с высоким содержанием растворенного вещества.
Концентрация раствора - количество вещества содержащегося в определенном количестве раствора или растворителя или в определенном объеме раствора. Концентрация раствора может быть выражена в различных единицах: в граммах, процентах, молях, граммэквивалентах. Концентрация веществ может выражаться в :
1. Процентах (процентная концентрация) – указывает какое количество растворенного вещества содержится в 100 грамм раствора
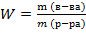 • 100%
• 100%
2. Молях (молярная концентрация) – указывает какое количество молей растворенного вещества содержится в 1 л. раствора. Для молярных растворов приняты следующие обозначения: одномолярные – 1М (1 моль вещества содержится в 1 л. раствора), двумолярные – 2М, децимолярные – 0,1 М и т.д.
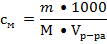
3. Граммэквивалентах (нормальная концентрация) – указывает какое количество граммэквивалентов растворенного вещества содержится в 1 л. раствора. Различают растворы: однонормальные – 1N (1Н) – 1 граммэквивалент растворен в 1 л. раствора, двунормальные 2N (2Н), полунормальные – 0,5 N, децинормальные – 0,1 N, сантинормальные – 0,01N и т.д.
4. 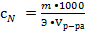
5. Грамм- эквивалент обозначается- Э. Эквивалент кислот находится по формуле
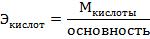
Например:
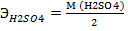 = 49г/моль
= 49г/моль
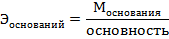
Например:
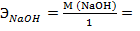 40г/моль
40г/моль
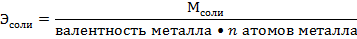
Например:
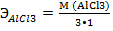 = 44,5 г/моль
= 44,5 г/моль
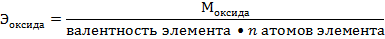
Например:
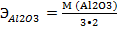 = 17 г/моль
= 17 г/моль
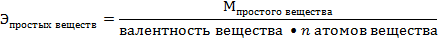
Например:
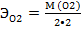 = 8 г/моль
= 8 г/моль
Какую массу химически чистого (х.ч.) йода следует взять для приготовления 500 мл 0,1н раствора?
Дано: Решение
Vр-ра= 500 мл 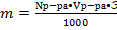
Nр-ра = 0,1 моль/л Э(I2) = 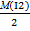
mв-ва - ? Э(I2) = 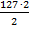 = 127 г/моль
= 127 г/моль
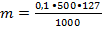 = 6,35 г.
= 6,35 г.
Ответ: mв-ва = 6,35 г.
При комнатной температуре в 1 л. воды можно растворить 2 г. CaSO4. Найдите молярную растворимость указанной соли.
Дано: Решение
Vр-ра= 1000 мл 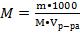
mв-ва = 2 г. М(CaSO4) = 40+32+64 = 136 г\моль
М - ? 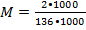 = 1,5•10-2 моль\л
= 1,5•10-2 моль\л
Ответ: M = 1,5•10-2 моль\л
Определите сколько грамм H2SO4 содержится в 1л.10% раствора H2SO4 p которой равна 1,07 г\мл.
Дано: Решение
Vр-ра= 1000 мл 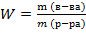 • 100%
• 100%
pр-ра = 1,07 г\мл 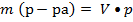
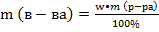
wр-ра = 10% m(р-ра) = 1000•1,07 = 1070 г.
m H2SO4 - ? 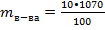 = 107 г.
= 107 г.
Ответ: m = 107 г.
Если при взаимодействии двух веществ образуется новое вещество, то доказательством происходящей химической реакции является уменьшение массы исходных веществ и увеличение массы получающихся веществ. Одни реакции протекают практически мгновенно (кислота + основание), другие при обычных условиях идут настолько медленно, что заметные изменения концентраций реагентов наблюдаются лишь через несколько лет (H2 + O2 → H2O в отсутствии катализаторов). При этом существуют множество реакций протекающих с вполне измеримыми скоростями в обычных условиях. Итак скорость химической реакции измеряют количеством вещества, прореагировавшими в единицу времени и выражают в молях на литр.
Скорость химической реакции зависит от условий, в которых она протекает: от концентрации реагентов, температуры, катализатора, излучения и т.д. Зависимость скорости реакции от концентрации реагирующих веществ впервые сформулирована в 1867 году норвежскими учеными Гульдбергом и Вааге и известна под названием закона действующих масс: «Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, измеряемых в молях на литр раствора»
V= k • c1 • c2 где
v – скорость реакции
c1 • c2 - концентрации реагирующих веществ
k – Коэффициент пропорциональности
k – Коэффициент пропорциональности зависит от природы реагирующих веществ, от температуры, но не зависит от концентрации реагирующих веществ.
Многие реакции не заканчиваются полностью, так как, продукты реакции могут реагировать между собой и образуются исходные вещества. Такие реакции называются обратимыми. Например:
ZnSO4 + H2S 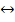 ZnS + H2SO4
ZnS + H2SO4
В таких реакциях ставят две стрелки. Реакции между исходными веществами называются прямой реакцией, а между полученными веществами – обратной. Скорость прямой реакции зависит от концентрации исходных веществ, а скорость обратной – от концентрации полученных веществ. В начале процесса скорость прямой реакции максимальна, а скорость обратной реакции равна нулю. По мере течения скорость прямой реакции убывает, так как, концентрация веществ уменьшается, а скорость обратной возрастает так, как, концентрации полученных веществ увеличиваются. И наступает такой момент, когда скорости процессов становятся равными. Состояние системы, при которой скорости прямой и обратной реакций равны, называется химическим равновесием.
При химическом равновесии прямая и обратная реакции идут с одинаковой скоростью в обоих направлениях.
Рассмотрим обратимую реакцию: A + B 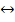 C + D
C + D
V1 = k1•[A]•[B]
А скорость обратной реакции
V2 = k2•[C]•[D]
k1 –коэффициент пропорциональности прямой реакции
k2 – коэффициент пропорциональности обратной реакции
В момент химического равновесия скорости прямой и обратной реакции равны между собой, т.е.
v1 = v2 или k1•[A]•[B] = k2•[C]•[D], отсюда
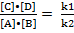 = K
= K
K – константа химического равновесия.
Константа химического равновесия равна отношению произведения концентраций полученных веществ к произведению концентраций исходных веществ с учетом коэффициентов. Например:
A + B +C 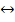 D + E
D + E
K = 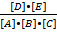
2A + B 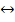 C + D
C + D
K = 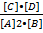
Вообще для прямой реакции 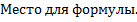
mA + nB  pC + qD
pC + qD
K = 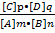
Это уравнение выражает закон действующих масс в общей форме
3H2 + N2 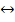 2NH3
2NH3
K = 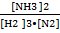
K – константа равновесия не зависит от концентрации реагирующих веществ, но зависит от температуры. При изменении внешних условий химическое равновесие нарушается, в системе происходит изменение, пока реакция не достигнет состояния равновесия в новых условиях. Пользуясь законом действия масс, можно управлять состоянием химического равновесия, т.е. вызывать сдвиг равновесия обратимых реакций в том, или ином направлении. Наибольшее значение имеют случаи нарушения равновесия вследствие изменения концентрации, какого либо вещества, давления, или температуры.
1. При увеличении концентрации, какого либо из веществ, участвующих в равновесии, равновесие смещается в сторону расхода этого вещества; при уменьшении концентрации какого-либо из веществ равновесие смещается в сторону образования этого вещества.
2. При увеличении давления равновесие сдвигается в сторону уменьшения числа молекул газов, т.е. в сторону понижения давления; при уменьшении давления равновесие смещается в сторону возрастания числа молекул газов, т.е. в сторону увеличения давления. Если реакция протекает без изменения числа молекул газов, равновесие не нарушается.
3. При повышении температуры равновесие смещается в сторону эндотермической, а при понижении температуры – в сторону экзотермической реакции.
Все эти три принципа известны под названием принципа Ле-Шателье
Если на систему находящуюся в равновесии, оказать какое- либо воздействие, то в результате протекающих в ней процессов равновесие сместиться в таком направлении, что оказанное воздействие уменьшится.
Задача №1
Как измениться скорость прямой реакции 2A + B 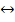 C , если концентрация A и B увеличится в 2 раза?
C , если концентрация A и B увеличится в 2 раза?
Дано: Решение
[A] 2A + B 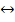 C
C
[B] V1 = k1•[A]2•[B] V2 = k2•[2A]2•[2B]
[2A] 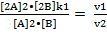 = 8 раз
= 8 раз
[2B]
V2\v1 - ?
Ответ: Скорость прямой реакции увеличится в 8 раз.
Вещества, водные растворы которых проводят электрический ток, называются электролитами. К ним относят кислоты, основания, соли. Распад молекул электролитов на ионы, под действием растворителя называется электролитической диссоциацией. Атомы, или группы атомов, несущие электрические заряды называются ионами. Каждый электролит распадается на катионы – ионы с положительным зарядом ядра, и анионы – ионы с отрицательным зарядом. Сумма зарядов катионов всегда равна сумме зарядов анионов.
Теория электролитической диссоциации была предложена в 1887 году Аррениусом. Заряд иона равен его валентности. Ионы обладают иными свойствами, чем атомы соответствующих элементов. Например: ионы хлора не имеют запаха, цвета, т.е. неттех качеств, свойств, которыми обладает газообразный хлор.
Различают сильные и слабые электролиты. Сильные – полностью распадаются на ионы, слабые – часть молекул остается в недиссоциированном состоянии. Отношение числа молекул, распавшихся на ионы, к общему числу растворенных молекул электролита называется степенью диссоциации. Она обозначается – 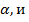 показывает какая доля всех молекул в растворе диссоциирована.
показывает какая доля всех молекул в растворе диссоциирована. 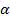 можно выражать, либо в процентах, либо в долях. Степень диссоциации одного и того же электролита в растворе зависит от температуры и от концентрации раствора.
можно выражать, либо в процентах, либо в долях. Степень диссоциации одного и того же электролита в растворе зависит от температуры и от концентрации раствора.
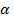 =
= 
Например: степень диссоциации 0,05 М раствора H2SO3 равна[
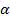 =
= 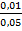 = 0,2;
= 0,2; 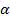 =
= 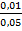 • 100% = 20%
• 100% = 20%
Когда говорят, что CH3COOH в 0,1 М растворе диссоциирована на 1, 3%, это означает, что в 1 литре раствора содержится
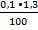 = 0,0013 – диссоциированных молей.
= 0,0013 – диссоциированных молей.
Диссоциация электролита – процесс обратимый. В растворе между концентрацией недиссоциированных молекул и концентрацией ионов, существует определенная зависимость. Например:
K = 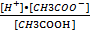
Константа диссоциации электролита равна отношению произведения концентраций ионов в растворе к концентрации недиссоциированных молекул этого электролита. Константа диссоциации не зависит от концентрации электролита и при данной температуре для одного и того же электролита есть величина постоянная. Определяя степень диссоциации, учитывают общее число растворенных молекул, а вычисляя константу диссоциации, учитывают число недиссоциированных молекул
K = 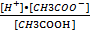 (1)
(1)
Обозначим 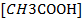 через С, степень диссоциации через
через С, степень диссоциации через 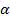 . Тогда число диссоциирующих молекул – С - С•
. Тогда число диссоциирующих молекул – С - С• 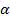 . Каждая распавшаяся молекула электролита образует по катиону
. Каждая распавшаяся молекула электролита образует по катиону 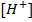 и по аниону
и по аниону 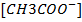 , т.е.
, т.е. 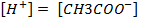 = С•
= С• 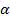
Подставляем в (1) уравнение значения
К = 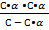 или К =
или К = 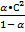 (2)
(2)
Уравнение (2) выражает закон разбавления Оствальда и устанавливает связь между степенью диссоциации и концентрацией слабого электролита. С увеличением концентрации, степень диссоциации уменьшается, а с уменьшением - возрастает, т.к. при данной температуре К – величина постоянная. Для очень слабых электролитов, где степень диссоциации очень мала, знаменатель в уравнение (2) можно принять за 1. Тогда
К = С• 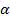 2 и
2 и 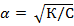
Отсюда следует, что степень диссоциации увеличивается, с уменьшением концентрации раствора, т.е. разбавлением его.
Степень диссоциации зависит:
1. От температуры ( в незначительной степени)
2. От концентрации ( в значительной степени)
3. Если в растворе присутствуют 2 электролита имеющие один общий ион, то говорят, что они имеют одноименный ион. Например: в растворе HCl и KCl ион Cl-. Если в таком растворе одинаковая степень диссоциации, одинаковая концентрация, то при смешивании этих растворов степень диссоциации каждого электролита не изменится.
4. Если к раствору слабой кислоты прибавить ее соль происходит значительное уменьшение степени диссоциации кислоты.
Степень диссоциации слабого электролита уменьшается, если внести в раствор сильный электролит с одноименным зарядом, даже если сильный электролит взят в малом количестве.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|