
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
кл. ОК 3 Планетарная модель атома. Постулаты Бора
9 кл. ОК 3 Планетарная модель атома. Постулаты Бора
Атомистическая теория - свыше двух тысячелетий назад. Демокрит: атом - неделимый. Сторонниками атомистической теории были М.В. Ломоносов,
Ж. Гей-Люссак др.
КОНЕЦ XIX в. – атом не является неделимым!
Дж. Томсон в 1897 г открыл электрон и в 1898 г. предложил модель атома в виде положительно заряженного шара радиусом 10-10 м. в котором «плавают» электроны, нейтрализующие положительный заряд.

Ядерная модель атома Э. Резерфорда
Экспериментальная проверка модели Томсона - 1908 - 1911 г., Эрнест Резерфорд (англ)
Идея опыта Резерфорда: зондирование атома с помощью α-частиц (заряд +2е, масса 6,64.10-27 кг).
Пучок α-частиц пропускался через тонкую золотую фольгу.
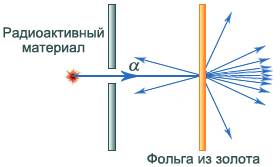
Э. Резерфорд обнаружил, что часть a-частиц отклоняется на значительный угол от своего первоначального направления, а небольшая часть отражается от фольги (т.о. модель Томсона находится в противоречии с опытами).
Резерфорд предложил ядерную (планетарную) модель строения атома:
1. В центре атома – массивное ядро (+), размеры его (d ~ 10-15 м) малы по сравнению с размерами атома(d ~ 10-10 м).
2. В ядре сконцентрирована почти вся масса атома
3. 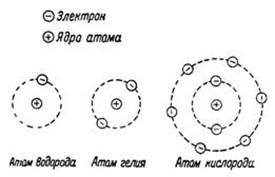 Вокруг ядра по своим орбитам движутся электроны (-) (подобно планетом в Солнечной Системе)
Вокруг ядра по своим орбитам движутся электроны (-) (подобно планетом в Солнечной Системе)
!! Число электронов ne в атоме численно = заряду ядра Z = порядковому номеру элемента в т. Менделеева . Заряд ядра определяется числом протонов в ядре (заряд ядра иногда называют зарядовым числом).
Пример: В атоме гелия(порядковый № 2)Z = 2, ne=2
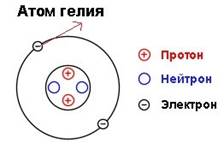
ЗАДАНИЕ 1:
С помощью таблицы Менделеева определите число электронов и заряд ядра в атомах кислорода, азота, свинца, золота, железа, ртути