
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Кулонометрия
Кулонометрия
В потенциометрии потенциал электрохимической ячейки в статических условиях используется для определения концентрации аналита. Как видно из предыдущего раздела, потенциометрия является важным и часто используемым количественным методом анализа. Динамические электрохимические методы, такие как кулонометрия, вольтамперометрия и амперометрия, при которых ток проходит через электрохимическую ячейку, также являются важными аналитическими методами. В этом разделе мы рассмотрим кулонометрические методы анализа. Вольтамперометрия и амперометрия рассматриваются в других разделах.
Кулонометрические методы анализа основаны на полном (исчерпывающем) электролизе аналита. Под исчерпывающим мы подразумеваем, что аналит количественно окисляется или восстанавливается на рабочем электроде или количественно реагирует с реагентом, генерируемым на рабочем электроде.
Существует две формы кулонометрии:
а) кулонометрия с контролируемым потенциалом, при которой постоянный потенциал подается на электрохимическую ячейку;
б) и кулонометрия с контролируемым током, при которой постоянный ток пропускается через электрохимическую ячейку.
Общий заряд Q в кулонах, прошедших при электролизе, связан с абсолютным количеством аналита по закону Фарадея
Q = nFN (11.23)
где n - число электронов, переносимых на моль аналита, F - постоянная Фарадея (96487 C моль – 1), а N – количества вещества аналита (моль).
1Кулон также эквивалентен 1A⋅1с [1Кл]=[1A]⋅[1с];
таким образом, для постоянного тока, заряд дается как
Q = ite (11.24)
где te - время электролиза.
Если ток изменяется во времени, как это происходит в кулонометрии с контролируемым потенциалом, то общий заряд равен (11.25).
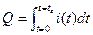 (11.25)
(11.25)
В кулонометрии измеряются ток и время, а для вычисления Q используется уравнение (11.24) или уравнение (11.25).
Уравнение (11.23) затем используется для определения количества вещества (в моль) аналита. Поэтому для получения точного значения N весь ток должен привести к окислению или восстановлению аналита. Другими словами, кулонометрия требует 100% -ной эффективности тока (выхода по току η) или точно измеренной эффективности тока, установленной с использованием стандарта, что необходимо учитывать при разработке кулонометрического метода анализа.
| Медиатор | Электрохимически генерируемый реагент | Реакция на генераторном электроде | Реакция в растворе |
|
| |||
ПРИМЕР 11.8.
Чистота образца Na2S2O3 определялась путем кулонометрического окислительно-восстановительного титрования с использованием I– в качестве промежуточного реагента (медиатора) и I3– в качестве «титранта». Образец весом 0,1342 г переносят в мерную колбу объемом 100 мл и разбавляют до объема дистиллированной водой. Порцию по 10,00 мл переносят в электрохимическую ячейку вместе с 25 мл 1 М KI, 75 мл фосфатного буфера с pH 7,0 и несколькими каплями раствора индикатора крахмала. Электролиз при постоянном токе 36,45 мА потребовал 221,8 с, чтобы достичь конечной точки титрования (индикатор крахмал). Определите чистоту образца.
РЕШЕНИЕ
Из таблицы 11.9 видно, что кулонометрическое титрование S2O32– с I3– составляет
2S2O32–(aq)+I3 –(aq) ↔ S4O62–(aq) + 3I–(aq)
Для окисления S2O32– до S4O62– требуется один электрон на S2O32– (n = 1). Объединение уравнений 11.23 и 11.24 и соответствующая замена на количество вещества (в моль) Na2S2O3 дает
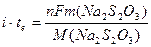
Решение для массы Na2S2O3 дает
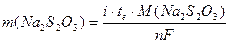
Обратите внимание, что расчет выполняется так, как если бы S2O32– окислялся непосредственно на рабочем электроде, а не в растворе.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|
